
| A. | 加水 | B. | 增加同浓度FeSO4的用量 | ||
| C. | 加压 | D. | 加入少量KMnO4晶体 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
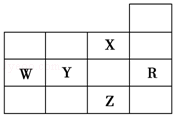 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | W元素的电负性大于Y元素的电负性 | |
| B. | X元素是电负性最大的元素 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | Y、Z的阴离子电子层结构都与R原子的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱式滴定管用蒸馏水洗涤之后装入KOH标准溶液,并读数 | |
| B. | 选择酚酞作指示剂,终点时溶液由无色刚好变成粉红色且半分钟不褪色 | |
| C. | 锥形瓶中从滴定开始到滴定终点时,水电离的c(H+)由小逐渐增大 | |
| D. | 滴定终点时,发现滴定管尖嘴处有气泡,则测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入等体积1mol/L的CH3COOH溶液 | B. | 升高温度 | ||
| C. | 加入NaOH溶液 | D. | 加入等体积0.1 mol•L-1 HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加生石灰,过滤 | B. | 加适量的AgNO3溶液 | ||
| C. | 加过量的Na2CO3溶液 | D. | 加CaCO3粉末,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$L | B. | $\frac{1}{3}$ L | C. | $\frac{1}{4}$L | D. | $\frac{1}{5}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
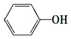 苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的
苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的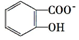
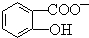 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重金属盐类能使蛋自质凝结.所以误食重金属盐类能使人中毒 | |
| B. | 在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解 | |
| C. | 人工合成具有生命活力的蛋白质--结晶牛胰岛素是我国科学家在1965年首次合成 | |
| D. | 浓硝酸溅在皮肤上能使皮肤呈现黄色,是由于浓硝酸和蛋白质发生了颜色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com