
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等,所以在中和滴定的研究中应用越来越广泛。
(1)某学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
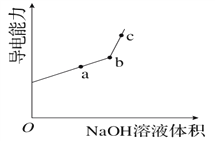
①用__________(填仪器名称)量取20.00 mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,测量结果将______________(选填“偏大”、“偏小”或“不影响”)。向锥形瓶中滴加0.1000 mol·L-1的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图如下图。

②醋酸与NaOH溶液反应的离子方程式为___________________________。
③图中b点时,溶液中各离子浓度大小的关系是_________________。
④若图中某一点pH等于8,则c(Na+)—c(CH3COO-)的精确值为________。
(2)将体积为10 mL pH=2的醋酸溶液与HX溶液分别加水稀释至1 000 mL,稀释过程pH的变化曲线如图所示,则HX的电离平衡常数________(填“大于”“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中由水电离出来的c(H+)______醋酸溶液中由水电离出来的 c(H+)。
(3)25 ℃时,CH3COOH的电离平衡常数K=1.8×10-5。在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的______倍。
【答案】 酸式滴定管 不影响 CH3COOH+OH-===CH3COO-+H2O c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 9.9×10-7mol·L-1 大于 大于 3.6×109
【解析】(1)①用酸式滴定管量取20.00mL醋酸溶液样品;锥形瓶中含有少蒸馏水,待测液的物质的量不变,V(标准)不变,根据c(待测)= 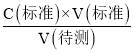 ,c(待测)不变,测量结果将不影响;②醋酸与NaOH溶液反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O;③图中b点,说明醋酸和NaOH恰好完全反应,醋酸钠水解,使得c(Na+)>c(CH3COO-),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);④c(H+)=10 -8mol/L,c(OH-)= 10 -6 mol/L,根据电荷守恒c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),c(Na+)- c(CH3COO-)= c(OH-) - c(H+)=10 -6 mol/L-10 -8mol/L=9.9×10 -7mol/L;(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,HX的电离平衡常数大于醋酸的电离平衡常数;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大于醋酸溶液中由水电离出来的 c(H+);(3)25 ℃时,CH3COOH的电离平衡常数K=1.8×10-5。在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约为
,c(待测)不变,测量结果将不影响;②醋酸与NaOH溶液反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O;③图中b点,说明醋酸和NaOH恰好完全反应,醋酸钠水解,使得c(Na+)>c(CH3COO-),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);④c(H+)=10 -8mol/L,c(OH-)= 10 -6 mol/L,根据电荷守恒c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),c(Na+)- c(CH3COO-)= c(OH-) - c(H+)=10 -6 mol/L-10 -8mol/L=9.9×10 -7mol/L;(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,HX的电离平衡常数大于醋酸的电离平衡常数;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大于醋酸溶液中由水电离出来的 c(H+);(3)25 ℃时,CH3COOH的电离平衡常数K=1.8×10-5。在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约为![]() ,酸抑制水的电离,则由水电离出的c(H+)= c(OH-)=
,酸抑制水的电离,则由水电离出的c(H+)= c(OH-)= 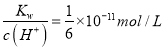 ,由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的
,由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的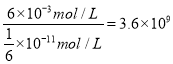 倍。
倍。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.CH4 B.(CH3)2C=CHCH3 C.C2H2 D.C6H14 E.CH2=CHCH=CH2 F.环戊烷
请回答下列问题:[第(1)(3)问请用A、B、C等代码作答,第(4)问请用化学用语作答]
(1)上述有机物中互为同系物的是________,互为同分异构体的是________。
(2)请用系统命名法对B进行命名__________。
(3)发生加聚反应后的产物中具有单双键相间排列结构的单体是__________。
(4)CH4的质谱图上质荷比为16的微粒符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20 ℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g·mL-120%的盐酸(20 ℃),搅拌,测量温度T3。
得到下表1的数据:
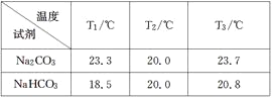
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是______________________(用离子方程式表示)。
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解____________________________________。
(3)分析表1的数据得出:Na2CO3固体溶于水________,NaHCO3固体溶于水________(填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向盛有10 mL水(20 ℃)的烧杯中加入10 mL________,搅拌,测量温度为22.2 ℃。
(5)结合上述探究,下列说法正确的是________。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1g混合物,加热至质量不变时,称其质量为m2g,则原混合物中NaHCO3的质量分数为________(用代数式表示)。
附表:溶解度表
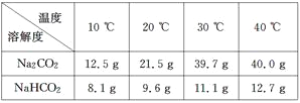 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2,为了检验产物中的H2和CO(设气体均被充分吸收),设计如下实验装置。下列有关说法错误的是
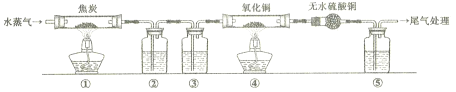
A. 为了实验安全,应先点燃①处酒精灯,后点燃④处酒精灯
B. ②、③、⑤中依次盛装氢氧化钠溶液、浓硫酸和澄清石灰水
C. ④中黑色固体变红色,即可证明产物中一定含有H2和CO中的一种或两种
D. 若用碱石灰替换无水硫酸铜,也可以达到检验H2和CO目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是组成生物体的部分高分子化合物与组成它们的化学元素的关系图:
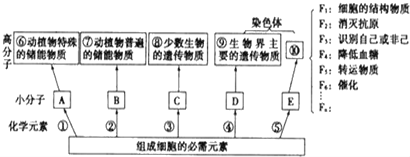
(1)构成小分子A、B、C、D、E的化学元素中,相同的元素有_____.
(2)写出下列高分子的名称:⑦___;⑨_____;⑩ _________.
(3)导致F1~Fn差别的原因是____________________________________.
(4)小分子C和D比较一定不同的是,前者含________,后者含______.
(5)写出下列物质的具体名称:F2为______;F6 为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧产生的SO2、CO、NO2等造成了严重的大气污染问题。
(1) CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H=-234 kJ·mol-1
③CaCO3(s)=CO2(g) +CaO(s) △H = +178 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)= 2CaSO4(s) △H =________ kJ·mol-1
向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2相应量的煤在相同条件下,燃烧时向环境释放出的热量会减少______ kJ。
(2)利用CO和H2在催化剂作用下合成甲醇,是减少污染的一种新举措,反应原理为CO(g)+2H2(g) ![]() CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
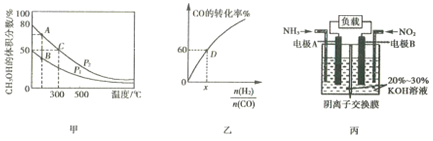
①上述合成甲醇的反应是______(填“吸热”或“放热”)反应,判断的理由是_____。
②图甲中A、B、C三点中反应速率最大的是______(填写“A”、“ B” 或“ C”)。
③在300℃时,向C点平衡体系中再充入0.25molCO,0.5molH2和0.25molCH3OH,该平衡______(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
(4)利用原电池原理可将NO2和NH3转化为无污染物质,其装置原理图如图丙所示,则负极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、E、F代表不同的大分子物质,请分析回答下列问题:
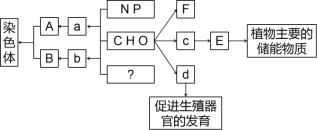
(1)在动物细胞内,与物质E作用最相近的物质是__________,若F为植物细胞细胞壁的主要成分,则它的合成主要发生在有丝分裂的________期。
(2)物质d和__________、胆固醇都属于固醇类物质。
(3)?处的元素为________,由多个b连接形成B的过程被称为_____________。
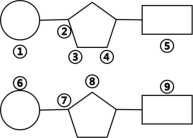
(4)下图为染色体结构中的一部分,若想将以下两个小分子以化学键连接起来,则连接的两点为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com