
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
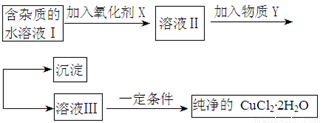
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
|
|
Fe3+ |
Fe2+ |
Cu2+ |
|
氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
|
氢氧化物沉淀完全时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)加入氧化剂的目的是
(2)下列最适合作氧化剂X的是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是
(4)如果不用物质Y而直接用可溶性碱溶液能不能达到目的? (填“能”或者“不能”)。若不能,试解释原因 (若填“能”,此空不用回答)
(5)最后能不能直接蒸发得到CuCl2·2H2O? (填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O (若填“能”,此空不用回答)
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 ,试解释原因
(8)FeCl3溶液具有净水作用的原因是
(1)将Fe2+氧化为Fe3+,便于生成沉淀与Cu2+分离(1分) (2)C (1分) (3)CuO(也可以是氢氧化铜、碳酸铜或者碱式碳酸铜) (1分) (4)不能(1分) ,加碱使Fe3+沉淀的同时也能使Cu2+沉淀(1分) (5)不能(1分) 应该在HCl气体氛围中进行蒸发结晶(2分) (6)碳酸钙溶解,产生气泡和红褐色沉淀(2分) (7)氢气(1分) 镁粉与氯化铁、氯化铜水解得到的氢离子作用,产生氢气(1分) (8)铁离子水解成氢氧化铁胶体,吸附水中的悬浮颗粒物,加速沉降。起到净水作用(2分)
【解析】
试题分析:(1)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质(2)加入过氧化氢能使亚铁离子氧化为铁离子,且不引入新杂质。故选C。(3)加入的物质Y可调节,使Fe3+全部沉淀,同时不引进新杂质,所以可以用Cu(OH)2、CuCO3、CuO、Cu2(OH)2CO3等。(5)不能,由于铜离子易水解,应在HCl气体氛围中进行蒸发结晶。(6)溶液Ⅱ中加入碳酸钙,由于溶液中含有H+,碳酸钙分解,形成二氧化碳气体和水,同时铁离子水解,形成氢氧化铁红褐色沉淀。(7)向溶液Ⅱ中加入镁粉,镁粉与氯化铁、氯化铜水解得到的氢离子作用,产生氢气。(8)铁离子水解成氢氧化铁胶体,吸附水中的悬浮颗粒物,加速沉降。起到净水作用。
考点:物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:阅读理解

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
选做题
从以下两道题中任选一道做。
1.光催化制氢是化学研究的热点之一。科学家利用含有吡啶环(吡啶的结构式为![]() ,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

(1)化合物Ⅱ的分子式为________________________________________。
(2)化合物Ⅰ合成方法如下(反应条件略,除化合物Ⅲ的结构未标明外,反应式已配平):
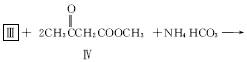
![]()
化合物Ⅲ的名称是_______________________。
(3)用化合物Ⅴ(结构式见下图)代替Ⅲ作原料,也能进行类似的上述反应,所得有机产物的结构式为____________________。

(4)下列说法正确的是________________(填字母)。
A.化合物Ⅴ的名称是间羟基苯甲醛,或2羟基苯甲醛
B.化合物Ⅰ具有还原性;Ⅱ具有氧化性,但能被酸性高锰酸钾溶液氧化
C.化合物Ⅰ、Ⅱ、Ⅳ都可发生水解反应
D.化合物Ⅴ遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
(5)吡啶甲酸酯可作为金属离子的萃取剂。2吡啶甲酸正丁酯(Ⅵ)的结构式见下图,其合成原料2吡啶甲酸的结构式为__________________;Ⅵ的同分异构体中,吡啶环上只有一个氢原子被取代的吡啶甲酸酯类同分异构体有____________________种。

Ⅵ
2.铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为_____________________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列说法正确的是_________________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_____________________。
(5)Cu2O的熔点比Cu2S的______________(填“高”或“低”),请解释原因____________________________。
@@1. (1)C11H13NO4 (2)甲醛
(3)
(4)BC
(5)![]() 12
12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com