
科目:高中化学 来源: 题型:

| 加热 |
| 加热 |
| 加热 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:吉林省长春市十一中2011-2012学年高一上学期期中考试化学理科试题 题型:022
阅读下列材料后,回答相应问题.
一个体重50 Kg的健康人大约含铁2 g,这2 g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在.二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4).服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收.
(1)人体中经常进行Fe2+![]() Fe3+的相互转化,在A过程中,Fe2+做________剂,在B过程中,Fe3+做________剂.
Fe3+的相互转化,在A过程中,Fe2+做________剂,在B过程中,Fe3+做________剂.
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子.”这句话指出,维生素C在这一反应中做________剂,具有________性.
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向0.2 mol/L 1 L FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________,此反应的离子方程式:________.
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
(三选一----化学与技术)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
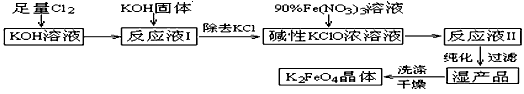
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
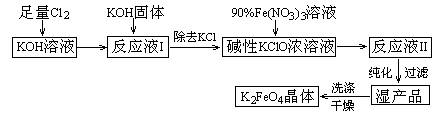
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
⑴该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
⑵写出工业上制取Cl2的化学方程式 ;
⑶K2FeO4具有强氧化性的原因 ;
⑷配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
⑸在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com