
| A. | 大烧杯上没有盖硬纸板 | |
| B. | 用环形铜丝搅拌棒代替环形玻璃搅拌棒 | |
| C. | 用相同浓度和体积的硝酸代替稀盐酸溶液进行实验 | |
| D. | 用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验 |
分析 根据实验的关键是保温,如果装置能量散失,则会导致结果偏低,如果装置得到能量,则会导致结果偏高,
A.根据不盖硬纸板,会有一部分热量散失;
B.根据金属的导热性很好,会导致热量的散失;
C.根据相同浓度和体积的硝酸代替稀盐酸都是稀的强酸,对实验无影响;
D.NaOH固体溶于水放热,温度升高.
解答 解:A.不盖硬纸板,会有一部分热量散失,使测得的△H数值偏小,故A错误;
B.用环形铜丝搅拌棒代替环形玻璃搅拌棒,金属的导热性很好,会导致热量的散失,使测得的△H数值偏小,故B错误;
C.相同浓度和体积的硝酸代替稀盐酸都是稀的强酸,对实验无影响,使测得的△H数值不变,故C错误;
D.NaOH固体溶于水放热,温度升高,使测得的△H数值偏大,故D正确;
故选D.
点评 本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
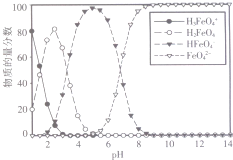 高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H4 | D. | CH4、C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | NaCl的电子式为 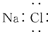 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸镁中加入稀盐酸:CO32-+2H+=CO2↑+H2O | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 冷的浓硝酸中加入过量铁粉:Fe+2NO3-+4H+=Fe2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
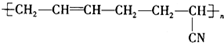 具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )| A. | ③⑥ | B. | ②③ | C. | ①③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C | B. | B>C>A | C. | C>A>B | D. | B>A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物一定易溶于水 | |
| B. | 离子化合物由非金属元素和金属元素共同组成 | |
| C. | 熔融状态下能够导电的物质,一定是离子化合物 | |
| D. | 离子化合物在固态时有离子存在,但不导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com