
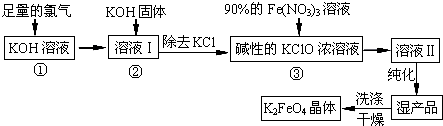
分析 足量氯气通入KOH溶液中低温反应生成KClO、KCl和水,加入固体KOH,KOH能和过量的氯气反应生成KClO且为下一步提供碱性环境,加入硝酸铁浓溶液纯化得到高铁酸钾,然后洗涤干燥得到高铁酸钾固体;
(1)温度较高时,氯气和KOH反应生成KCl、KClO3和水;该反应中Cl元素化合价由0价转化为-1价、+5价,转移电子数为5,根据氯气和转移电子之间关系式计算;
(2)根据生产工艺流程图,第①步氯气过量,第③步需要碱性条件,在温度较高时KOH与Cl2反应生成的是KClO3,氧化还原反应中化合价有升有降;
(3)硝酸钾能作化肥、炸药;碱性条件下,次氯酸钾和硝酸铁发生反应生成高铁酸钾、KCl和水;
(4)检验最后一次的洗涤中无Cl-即可;最高价态的元素具有强氧化性;
(5)该反应中Fe元素化合价由+3价变为+6价,O元素化合价由-2价变为0价,根据转移电子守恒、电荷守恒及原子守恒配平方程式.
解答 解:足量氯气通入KOH溶液中低温反应生成KClO、KCl和水,加入固体KOH,KOH能和过量的氯气反应生成KClO且为下一步提供碱性环境,加入硝酸铁浓溶液纯化得到高铁酸钾,然后洗涤干燥得到高铁酸钾固体;
(1)温度较高时,氯气和KOH反应生成KCl、KClO3和水;该反应中Cl元素化合价由0价转化为-1价、+5价,转移电子数为5,反应方程式为6KOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O,
该反应中如果消耗3mol氯气,则转移5mol电子,所以当转移5mol电子时消耗3mol氯气,消耗的氯气在标准状况下的体积约为=3mol×22.4L/mol=67.2L
故答案为:6KOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O;67.2;
(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
B、因温度较高时KOH 与Cl2 反应生成的是KClO3,而不是KClO,故B错误;
C、第③步需要碱性条件,所以碱要过量,故C正确;
D、KClO3转化为KClO,化合价只降不升,故D错误;
故选:AC;
(3)硝酸钾能作化肥和炸药;
据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:硝酸钾作化肥和炸药;2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净;高铁酸钾中Fe元素处于最高价态,能得电子而作强氧化剂,
故答案为:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净;高铁酸钾中Fe元素处于最高价态,只能得电子而具有强氧化性;
(5)该反应中Fe元素化合价由+3价变为+6价,O元素化合价由-2价变为0价,根据转移电子守恒、电荷守恒及原子守恒配平方程式,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,故答案为:
4;10;4;3;8OH-.
点评 本题考查物质制备,为高频考点,还涉及离子检验、氧化还原反应方程式配平等知识点,明确流程图中每一步可能发生的反应及基本操作方法是解本题关键,会根据原子守恒、转移电子守恒配平方程式,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | 重结晶是提纯固体的常用方法,碘单质亦可在水溶液中通过重结晶提纯 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥⑦⑧ | B. | ①③⑤⑦ | C. | ①③④⑥⑧ | D. | ①④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46gNO2含有2NA个分子 | |
| B. | 标准状况下,1.12L1H2和0.2g2H2均含有0.1NA个质子 | |
| C. | 室温时,1LpH=2的NH4Cl溶液中水电离出H+的数目为10-12NA | |
| D. | 过氧化氢分解制得标准状况下1.12LO2,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生反应生成CO2和H2并放出热量,CO和H2O浓度变化如图:
在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生反应生成CO2和H2并放出热量,CO和H2O浓度变化如图: CO2+H2
CO2+H2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 96倍 | B. | 48倍 | C. | 24倍 | D. | 12倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 能导电 | 电解质 | 非电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ③⑤⑥⑨⑩ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CCl4萃取碘水中的I2 | B. | 粗盐(混有泥沙、MgSO4•FeCl3)的提纯 | ||
| C. | 用蒸馏方法分离CCl4和I2的混合物 | D. | 用浓HCl配制一定量浓度的稀HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com