
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
| A. | -1928 | B. | +1928 | C. | +1838 | D. | -1838 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物中也可能含有离子键 | |
| B. | 非金属之间形成的化学键一定是共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 含有金属元素的离子一定是阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和盐酸反应CO32-+2H+═H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液Ba2++SO42-═BaSO4↓ | |
| C. | 向稀盐酸溶液中加铁3Fe+6H+═3Fe3++3H2↑ | |
| D. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
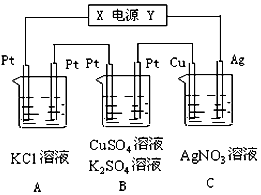
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O | |
| B. | 将Na投入到CuSO4溶液中:2Na+Cu2+═2Na++Cu↓ | |
| C. | 大理石溶于醋酸中:CaCO3+2CH3COOH═CO2++2CH3COO-+CO2↑+H2O | |
| D. | 将Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
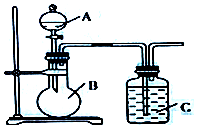
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
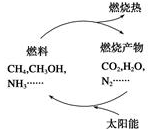 能量是当今社会发展的三大支柱之一.利用太阳能让燃料的燃烧产物如CO2、H2O、N2等重新组合,从而实现如图所示的转化.在此物质循环中太阳能转化为( )
能量是当今社会发展的三大支柱之一.利用太阳能让燃料的燃烧产物如CO2、H2O、N2等重新组合,从而实现如图所示的转化.在此物质循环中太阳能转化为( )| A. | 化学能 | B. | 核能 | C. | 机械能 | D. | 电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
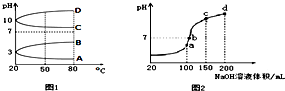 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com