
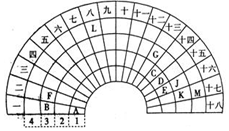
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题: .
. .
.分析 由位置可知,A为H,B为Na,C为C,D为N,E为O,F为Mg,G为Al,J为S、K为Cl,M为Br,L为Fe,
(1)E为O,G为Al,Al的离子核外有10个电子;
(2)CE2为CO2,其电子式为 ;
;
(3)A和M形成的化合物为HBr,与氯气反应生成溴,加四氯化碳发生萃取;
解答 解:由位置可知,A为H,B为Na,C为C,D为N,E为O,F为Mg,G为Al,J为S、K为Cl,M为Br,L为Fe,
(1)E位于第二周期第VIA族,Al的离子结构示意图为 ,故答案为:第二周期第VIA族;
,故答案为:第二周期第VIA族; ;
;
(2)CE2为CO2,其电子式为 ,故答案为:
,故答案为: ;
;
(3)A和M形成的化合物为HBr,与氯气反应生成溴,离子反应为Cl2+2Br-=Br2+2Cl-,加四氯化碳发生萃取,现象为下层溶液呈橙红色,
故答案为:Cl2+2Br-=Br2+2Cl-;下层溶液呈橙红色.
点评 本题考查元素的位置、结构与性质,为高频考点,把握短周期及扇形结构与现行周期表的对应关系推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律及元素化合物知识的应用,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| B. | 稀H2SO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═2C6H5OH+SO32- | |
| D. | 醋酸钠的水解反应:CH3COO-+H3O+═CH3COOH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
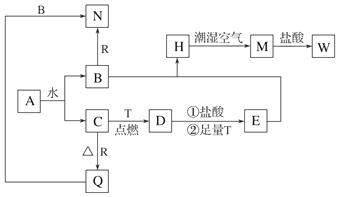
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;A与C组成的化合物为MgS(用具体元素符号表示).
;A与C组成的化合物为MgS(用具体元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  | 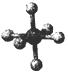 |  |  |
| 备注 | 熔点187K | 易溶于CS2 |
| A. | 单质硼属分子晶体,其结构单B12中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | NaCl晶体中每个Na+周围距离最近的Na+有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com