
聚甲基丙烯酸酯( )的缩写代号为PMMA,俗称有机玻璃。下列说法中错误的是
)的缩写代号为PMMA,俗称有机玻璃。下列说法中错误的是
A.聚甲基丙烯酸甲酯属于有机干分子合成材料
B.聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n
C.合成PMMA的单体是甲基丙烯酸和甲醇
D.甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
在无色的强碱性溶液中,能大量共存的是( )
A.Na+、Al3+、NO3-、Cl- B.K+、Na+、Cl-、AlO2-
C.Fe2+、K+、SO42-、Cl- D.Na+、HCO3-、K+、NO3-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上开学测化学试卷(解析版) 题型:选择题
分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( )

A.1mol分枝酸最多可与3molNaOH发生中和反应
B.可与乙醇、乙酸反应,且反应类型相同
C.分子中含有2 种官能团
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色.且原理相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:选择题
己知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-a kJ·mol-l
②CH4(g) +2O2 (g) =CO2 (g) +2H2O(g) △H=-b kJ·mol-l
⑧CH4(g) +2O2 (g) =CO2 (g) +2H2O(1) △H=-c kJ·mol-l
则下列叙述正确的是
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ/mol
C.2CH3OH (g) =2CH4(g)+O2(g) △H=2(b-a) kJ·mol-l
D.当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O (1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三第一次摸底化学试卷(解析版) 题型:填空题
合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用。
(1)已知:N2(g)+O2(g)=2NO(g) △H1
H2(g)+1/2O2(g)=H2O(1) △H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3
N2(g)+3H2(g)?2NH3(g) △H4<0
则△H4= (用含△H1、△H2、△H3的代数式表示)。
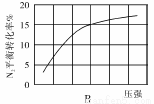
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如下图A、B所示,其中正确的是 (填“A”或“B”),其判断理由是 。

(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
①实验Ⅰ前10秒的平均速率v(NH3)= mol·L-1·s-1,T1温度下合成氨反应的平衡常数K= (列出计算式)。
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是 。
③与实验I相比,实验Ⅲ中N2的平衡转化率 (填“增大”、“减小”或“不变”),平衡常数K (填“增大”、“减小”或“不变”)。
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1 (填“大于”、“小于”或“等于”)T2,原因是 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
(1)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。

(2)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
(3)为安全起见,工业生产中需对空气中的CO进行检测。
①粉红色的PdCl2溶液可以检测空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应中转移的电子数为 。
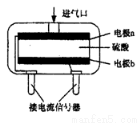
②使用电化学CO气体传感器定量检测空气中CO含量,其模型如图所示。这种传感器利用了原电池原理,则该电池的负极反应式为 。
(4)CO与Fe在一定条件下可形成五羰基铁[Fe(CO)5],该化合物易吸收H2生成氢化羰基铁。氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠。五羰基铁吸收H2的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向Na2SiO3溶液中滴加几滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
B | 取久置的Na2O2粉末,向其中滴加过量的盐酸后产生气体 | Na2O2没有变质 |
C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀 | 溴乙烷没有水解 |
D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
在2升的密闭容器中,发生以下反应:2A(g)+B(g)?2C(g)+D(g).若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12mol/(L•s),则10秒钟时,容器中B的物质的量是( )
A.1.6mol B.2.8mol C.2.4 mol D.1.2mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高二上学期入学考试化学试卷(解析版) 题型:选择题
在溶液中加入中量Na2O2后仍能大量共存的离子组是
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com