
| ||
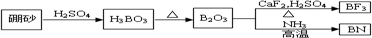
 ;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3;
;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3; ;N;+3;
;N;+3;
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氯化钠溶于水中 |
| B、NH3 (g)和HCl(g)反应生成NH4Cl |
| C、干冰的升华 |
| D、CaCO3 (S)分解为CaO(S)和CO2 (g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙炔 | B、1-丁炔 | C、丁烯 | D、苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气 |
| B、实验室做硝酸实验中排放的废气 |
| C、硫酸工业排放的废气 |
| D、家用液化气不完全燃烧的产生的废气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
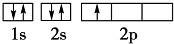
| A、表示一个原子在第三能层上有10个电子应该写成3s23p63d2 |
| B、电子排布1s22s22p7违背了泡利原理 |
| C、基态铁原子的外围电子排布式为4s2 |
| D、基态Si原子的电子排布式为1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
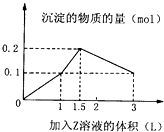 某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
某1L混合溶液中,溶质X、Y的浓度都为0.1mol?L-1,向混合溶液中滴加某溶液Z(0.1molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )| A、硫酸铝、硫酸铁、氢氧化钠 |
| B、硫酸铝、硫酸镁、氢氧化钠 |
| C、偏铝酸钠、氢氧化钡、硫酸 |
| D、偏铝酸钠、氯化钡、硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
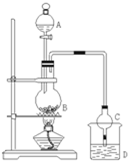 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
| 密度(g/cm3) | 0.714 | 0.789 | 1.049 | 0.903 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com