
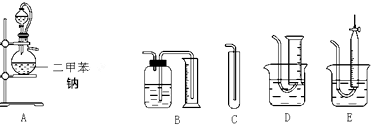
分析 (1)氢气密度比空气小,不能排空气法收集,只能排水法收集,D试管无刻度,液体的体积无法读出,E中滴定管下端液体的体积无法读出;
(2)分液漏斗与蒸馏烧瓶之间连接导管能使烧瓶与分液漏斗中压强保持一致,便于液体滴下;
(3)将小块钠在二甲苯中熔化成小钠珠,增大固体表面积可以加快反应速率;
(4)依据2CH3CH2OH~H2解答;
(5)根据选项的实验操作分析对测定结果的影响.
解答 解:(1)氢气密度比空气小,不能排空气法收集,只能排水法收集,D试管无刻度,液体的体积无法读出,E中滴定管下端液体的体积无法读出,所以只能选B,
故选:B;
(2)A部分中分液漏斗与蒸馏烧瓶之间连接导管能使烧瓶与分液漏斗中压强保持一致,分液漏斗的液柱差使乙醇易于滴下,
故选:C;
(3)将小块钠在二甲苯中熔化成小钠珠,增大固体表面积可以加快反应速率,使乙醇与钠充分反应,
故答案为:增大无水乙醇与钠的接触面积,使之充分反应;
(4)无水酒精的物质的量为:$\frac{ρg•cm-1×VmL}{46g/mol}$,气体的物质的量为$\frac{a×1{0}^{-3}L}{22.4L/mol}$,则2H~H2知能被钠取代出的氢原子为$\frac{a×1{0}^{-3}L}{22.4L/mol}$×2,所以一个乙醇分子中能被钠取代出的氢原子数为:$\frac{\frac{a×10{\;}^{-3}L}{22.4L/mol}×2}{\frac{ρg•cm{\;}^{-1}×VmL}{46g/mol}}$=$\frac{46a}{11200Vρ}$;
故答案为:$\frac{46a}{11200Vρ}$;
(5)a.反应速率太快,对产生氢气体积不产生影响,测定结果不变,故a不选;
b.无水酒精中混有微量甲醇,导致羟基的物质的量增大,产生的氢气的物质的量偏大,测定结果偏高,故b选;
c.读数时量筒内的液面高于广口瓶内的液面,导致排除液体体积偏小,测定结果偏低,故c不选;
故选:b.
点评 本题考查了物质组成的成分探究实验分析判断,将实验、计算、确定有机物分子结构相结合,实验设计与实验原理兼有的综合性实验题,题目难度中等,侧重培养学生规范严谨的实验设计能力,有利于调到学生的学习兴趣,激发学生学习化学的积极性.


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
 一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )
一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )| A. | 反应的化学方程式为A(g)+B(g)?D(g) | |
| B. | 反应开始到10s,用B表示的反应速率为0.079mol/(L•s) | |
| C. | 在10s时,D的体积分数为71.8% | |
| D. | 反应开始到10s时,A的转化率为79% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 燃烧法是研究确定有机物成分的有效方法 | |
| C. | 1H核磁共振谱通常用于分析有机物的相对分子质量 | |
| D. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子中3个碳原子在同一条直线上 | B. | 分子中所有原子都在同一平面上 | ||
| C. | 能使溴的四氯化碳溶液褪色 | D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A为茉莉香型香料.
有机物A为茉莉香型香料. .
.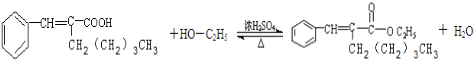 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com