
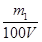 ≤ c(NaOH) ≤
≤ c(NaOH) ≤ 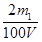 (每种情况各1分,共3分)
(每种情况各1分,共3分) mol/L(2分)
mol/L(2分)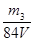 mol/L(2分) (其它合理答案也给分)
mol/L(2分) (其它合理答案也给分)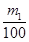 mol,在标准状况下的体积为
mol,在标准状况下的体积为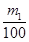 mol×22.4L/mol=0.224m1 L。
mol×22.4L/mol=0.224m1 L。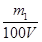 ;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)=
;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)= 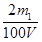 ;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以:
;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以: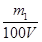 ≤ c(NaOH) ≤
≤ c(NaOH) ≤ 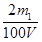 。
。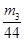 ,则氢氧化钠的物质的量也是
,则氢氧化钠的物质的量也是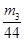 ,所以其浓度为
,所以其浓度为 。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为
。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为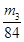 ,则根据原子守恒可知氢氧化钠的物质的量也是
,则根据原子守恒可知氢氧化钠的物质的量也是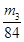 ,所以其浓度为
,所以其浓度为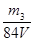 。
。

科目:高中化学 来源:不详 题型:单选题
| A.一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2NA |
B.256 g S8分子中含S-S键为7NA个 |
| C.由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.步骤Ⅰ中减少的3 g固体一定是混合物 |
| B.步骤Ⅱ中质量减少的物质一定是Cu |
| C.根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 |
| D.根据上述步骤Ⅱ可以得出m(Fe2O3)∶m(Cu)=1∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温常压下,1.7gH2O2中含有的电子数为0.9NA |
| B.1 mol.L-1CuCl2溶液含有2NA个Cl- |
| C.1 mol Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子 |
| D.标准状况下,2.24L戊烷所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定温度、压强下,气体体积由其分子的大小决定 |
| B.一定温度、压强下,气体体积由其物质的量的多少决定 |
| C.气体摩尔体积是指1mol任何气体所占的体积为22.4L |
| D.不同的气体,若体积不等,则它们所含的分子数一定不等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA |
| B.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C.1 mol Al3+离子含有的核外电子数为3NA |
| D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.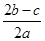 | B.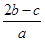 | C.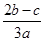 | D.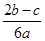 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,11.2 L H2O中氧原子的数目大于0.5 NA |
| B.6.0 g醋酸晶体中含有H+的数目为0.1 NA |
| C.64gCu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA |
| D.1 mol Cl-含有的核外电子总数为8 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com