
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算,注意水的密度为1g/mL,以此解答.
解答 解:n(H2O)=$\frac{3.01×1{0}^{24}}{6.02×1{0}^{23}/mol}$=5mol,m(H2O)=5mol×18g/mol=90g,水的密度为1g/mL,则体积为90mL,含有10molH;
与 5mol CH4 含有相同的分子数,与2.5mol CH4 含有相同的氢原子数.
故答案为:5mol;90g;90mL;5;2.5.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算,有利于基础知识的巩固.


科目:高中化学 来源: 题型:填空题
 ②
② ③
③ ④
④ ⑤
⑤
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{10m}{143.5}$ | B. | $\frac{100m}{143.5}$ | C. | 18-$\frac{100m}{143.5}$ | D. | 18-$\frac{10m}{143.5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:7:11 | B. | 10:11:9 | C. | 10:11:8 | D. | 11:9:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol | B. | 0.25 mol | C. | 0.5 mol | D. | 1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
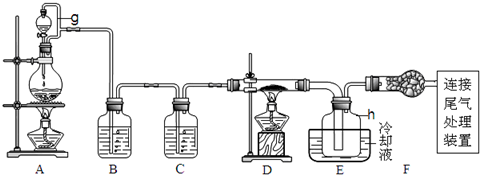
| 物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | - | 315 | - |
| 熔点/℃ | -70.0 | - | - | - |
| 升华温度/℃ | - | 180 | 300 | 162 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com