
| A. | NH4Cl溶液、NaOH溶液、碱石灰 | B. | 浓氨水、NaOH固体、浓硫酸 | ||
| C. | NH4Cl固体、消石灰、碱石灰 | D. | 浓NaOH溶液、NH4Cl固体、浓硫酸 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
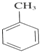 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$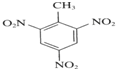 +3H2O;
+3H2O; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱 | |
| B. | 在 MgCl2与 AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱 | |
| C. | 硫酸和硅酸钠溶液反应出白色沉淀,判断硫与硅的非金属活动性强弱 | |
| D. | Br2 与 I2分别与足量的 H2反应,判断溴与碘的非金属活动性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | Na+、Fe3+、Cl-、SCN- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第9列元素中有非金属元素 | |
| B. | 只有第二列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第8列元素是铁元素 | |
| D. | 第15列元素原子的最外层电子排布为ns2 np5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )
分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )| A. | 元素非金属性q>n>p | |
| B. | 原子半径的大小m>q>n>p | |
| C. | Q的溶液可以保存在细口玻璃试剂瓶 | |
| D. | n的氧化物的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
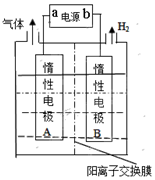 LiOH常用于制备锂离子电池正极材料.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )
LiOH常用于制备锂离子电池正极材料.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )| A. | a是电源的负极 | |
| B. | B极区电解液为LiOH溶液 | |
| C. | A电极的电极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 外电路中每通过0.1 mol电子,生成1.12 L氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com