
 目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2反应.
目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2反应.分析 (1)根据图象知,该反应的正反应是放热反应,能使c(CH3OH)增大,说明平衡向正反应方向移动;
(2)依据化学平衡在不同温度下二氧化碳的转化率计算,比较反应进行程度大小,确定温度高低;
(3)①利用盖斯定律计算反应热,并书写热化学方程式;
②该反应消耗二氧化碳,可降低温室效应,生成甲醇,可弥补资源短缺;
③根据△G=△H-T△S判断反应能否自发进行.
解答 解:(1)A.升高温度,平衡逆向移动,c(CH3OH)减小,故错误;
B.充入He(g),使体系压强增大,由于容器为恒容容器,各组分浓度不变,平衡不移动,c(CH3OH)不变,故错误;
C.将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大,故正确;
D.再充入1mol CO2和3molH2,平衡正向移动,c(CH3OH)增大,故正确.
故答案为:CD;
(2)在温度T1时,当反应达到平衡时,测得n(H2)=2.4mol,则平衡时n(CO2)=1mol-$\frac{1}{3}$×(3mol-2.4mol)=0.8mol;其他条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82mol,说明平衡向正反应方向移动,反应为放热反应,降低温度平衡向正反应方向移动,故答案为:>;
(3)①甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)=2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式$\frac{3}{2}$×②-①×$\frac{1}{2}$,所以△H=$\frac{3}{2}$×(-571.6KJ/mol)-(-1451kJ/mol)×$\frac{1}{2}$=-131.9KJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l),△H=-131.9KJ/mol;
②该反应消耗二氧化碳,可降低温室效应,生成甲醇,可弥补资源短缺,故答案为:可降低温室效应和弥补资源短缺;
③该反应是一个焓增、熵减的反应,则△G=△H-T△S>0,不能自发进行,
故答案为:不可行,该反应是一个焓增、熵减的反应,所以不能自发进行.
点评 本题考查化学平衡以及反应热的计算,题目难度较大,本题注意利用三段式法计算.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | CO32-、H+、HCO3-、Ca2+ | B. | NH4+、OH-、Ba2+、NO3- | ||
| C. | I-、ClO-、NO3-、H+ | D. | SO32-、SO42-、Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液出现蓝色浑浊 | B. | 钠块熔成小球浮在水面四处游动 | ||
| C. | 有气体产生 | D. | 有红色的铜被置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
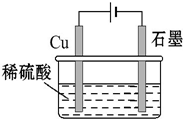
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主要反应方程式为:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一段时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度不断减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com