
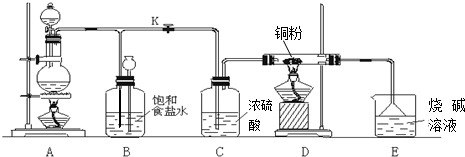
·ÖĪö £Ø1£©¶žŃõ»ÆĆĢÓėÅØŃĪĖį·“Ӧɜ³ÉĀČĘų£»
£Ø2£©ĀČĘųÓėĶ·“Ӧɜ³ÉĀČ»ÆĶ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗCu+Cl2$\frac{\underline{\;\;”÷\;\;}}{\;}$CuCl2£»
£Ø3£©±„ŗĶŹ³ŃĪĖ®ŹĒĪüŹÕĀČĘųÖŠµÄĀČ»ÆĒāĘųĢ壬ÅØĮņĖįŹĒøÉŌļĀČĘųÖŠĖ®ÕōĘų£¬E×°ÖĆÖŠµÄĒāŃõ»ÆÄĘĪüŹÕ¶ąÓąµÄĀČĘų£¬·ĄÖ¹Ōģ³É“óĘųĪŪČ¾£»
£Ø4£©µ±D“¦·“Ó¦Ķź±Ļŗó£¬ŅĘČ„A“¦¾Ę¾«µĘ£¬ČŌÓŠÉŁĮæCl2²śÉś£¬½ÓĻĀĄ“Ó¦½ųŠŠµÄ²Ł×÷ŹĒŹ×ĻČĻØĆšD“¦µÄ¾Ę¾«µĘ£¬¹Ų±Õ»īČūK£¬ČĆÓąČČ²śÉśµÄĘųĢåÖü“ęµÄBÖŠ£®
½ā“š ½ā£ŗ£Ø1£©¶žŃõ»ÆĆĢÓėÅØŃĪĖį·“Ӧɜ³ÉĀČĘų£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗMnO2+4HCl$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2”ü+2H2O£¬¹Ź“š°øĪŖ£ŗMnO2+4HCl$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2”ü+2H2O£»
£Ø2£©ĀČĘųÓėĶ·“Ӧɜ³ÉĀČ»ÆĶ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗCu+Cl2$\frac{\underline{\;\;”÷\;\;}}{\;}$CuCl2£¬¹Ź“š°øĪŖ£ŗCu+Cl2$\frac{\underline{\;\;”÷\;\;}}{\;}$CuCl2£»
£Ø3£©±„ŗĶŹ³ŃĪĖ®ŹĒĪüŹÕĀČĘųÖŠµÄĀČ»ÆĒāĘųĢ壬ÅØĮņĖįŹĒøÉŌļĀČĘųÖŠĖ®ÕōĘų£¬E×°ÖĆÖŠµÄĒāŃõ»ÆÄĘĪüŹÕ¶ąÓąµÄĀČĘų£¬·ĄÖ¹Ōģ³É“óĘųĪŪČ¾£¬¹Ź“š°øĪŖ£ŗĪüŹÕCl2ÖŠµÄHClĘųĢ壻øÉŌļĀČĘų£»ĪüŹÕ¶ąÓąµÄĀČĘų£¬·ĄÖ¹ĪŪČ¾æÕĘų£»
£Ø4£©µ±D“¦·“Ó¦Ķź±Ļŗó£¬ŅĘČ„A“¦¾Ę¾«µĘ£¬ČŌÓŠÉŁĮæCl2²śÉś£¬½ÓĻĀĄ“Ó¦½ųŠŠµÄ²Ł×÷ŹĒŹ×ĻČĻØĆšD“¦µÄ¾Ę¾«µĘ£¬¹Ų±Õ»īČūK£¬ČĆÓąČČ²śÉśµÄĘųĢåÖü“ęµÄBÖŠ£¬¹Ź“š°øĪŖ£ŗČöČ„D“¦µÄ¾Ę¾«µĘ£¬¹Ų±Õ»īČūK£¬Öü“ęÓąČČ²śÉśµÄCl2£®
µćĘĄ ±¾Ģāæ¼²éĮĖĀČĘųµÄŹµŃéŹŅÖĘ·Ø£¬ÄѶČÖŠµČ£¬Ć÷Č·ĀČĘųŹĒÓŠ¶¾µÄĘųĢ壬ŅŖ½ųŠŠĪ²ĘųµÄ“¦Ąķ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČŌ×ӵĽį¹¹Ź¾ŅāĶ¼£ŗ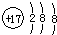 | |
| B£® | ×÷ĪŖĻą¶ŌŌ×ÓÖŹĮæ²ā¶Ø±ź×¼µÄĢ¼ŗĖĖŲ£ŗ12C | |
| C£® | °±Ęų£ØNH3£©ÖŠµŖŌŖĖŲµÄ»ÆŗĻ¼ŪŹĒ+3 | |
| D£® | ŅŅ“¼µÄ½į¹¹¼ņŹ½£ŗC2H5OH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ļ”ĮņĖį | B£® | ÅØĮņĖį | C£® | ÅØŃĪĖį | D£® | ĮņĖįĶČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.02 mol/£ØL•s£© | B£® | 0.04 mol/£ØL•s£© | C£® | 0.08 mol/£ØL•s£© | D£® | 0.12 mol/£ØL•s£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4L¶žĀČ¼×ĶéµÄ·Ö×ÓŹżŌ¼ĪŖNA | |
| B£® | 78æĖNa2O2ŗ¬ÓŠŅõĄė×ÓŹżĪŖ2NA | |
| C£® | ³£ĪĀĻĀ£¬ŌŚ18g 18O2ÖŠŗ¬ÓŠŃõŌ×ÓŹżĪŖNA | |
| D£® | 1mol-OHĖłŗ¬µÄµē×ÓŹżÄæĪŖ7NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ū¢Ü¢Ž | B£® | ¢Ł¢Ś¢Ż¢Ž | C£® | ¢Ł¢Ū¢Ü¢Ż | D£® | Č«ÓŠ¹Ų |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com