
| A.在稀盐酸中 c(H+)=c(Cl—)+c(OH—) |
B.常温下,在0.1mol/L的HNO3溶液中由水电离出的c(H+)<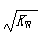 |
| C.将Na2CO3水溶液加热、蒸干,最后得到NaOH固体 |
| D.酸与碱完全中和,所得溶液的pH可能大于7 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.甲是向溴水通入SO2气体时,pH与SO2物质的量的关系图 |
| B.乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C.常温常压下,将2b mol CO2气体通入1L bmol·L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中有CaF2沉淀产生 | D.加入CaCl2溶液后体系中的c(H+)浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.HA为一元强酸 |
| B.N点水的电离程度小于K点水的电离程度 |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
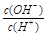 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度 /(mol·L-1) | 2 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com