
| m |
| M |
| 3.1g |
| 31g/mol |
| 3.2g |
| 32g/mol |
| 1mol |
| 0.05mol |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、S2?、Cl?、K+、Ca2+半径逐渐减小 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
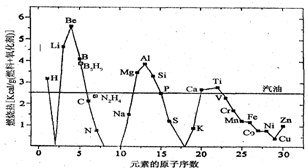
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧元素的一种同位素 |
| B、臭氧的同素异形体 |
| C、一种新的氧化物 |
| D、可能是非极性键构成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g氢气所含的原子数 |
| B、4g氦气所含的原子数 |
| C、12.6g HNO3所含的原子数 |
| D、0.5mol氧气所含的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、NaNO2是还原剂 |
| B、NH4Cl是氧化剂 |
| C、反应中有离子键、极性共价键和非极性共价键的断裂和形成 |
| D、每生成lmolN2,NaNO2得到3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
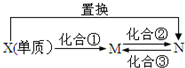 M、N为含X元素的常见化合物,它们之间有如下图的转化关系.下列说法正确的是( )
M、N为含X元素的常见化合物,它们之间有如下图的转化关系.下列说法正确的是( )| A、X可以是S或Cu元素 | ||||
| B、化合②③的反应可以是非氧化还原反应 | ||||
C、若X为C元素,则该转化关系中X单质发生的置换反应可以是2C+SiO2
| ||||
| D、若X为Fe元素,则M的H218O溶液中加入固体Na2O2的反应为:4Fe3++6H218O+6Na2O2═4Fe(OH)3↓+12Na++318O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com