
【题目】化合物M(C16H14O2)是一种香料,工业上常利用烃A和甲苯为主要原料,按下列路线合成:

已知:①气态烃A在标准状况下的密度是1.25g·L-1;
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
![]() 请回答下列问题:
请回答下列问题:
(1)F的名称是_______________;M中含有的官能团名称是________________。
(2)写出B→C的化学方程式_______________________________________。
(3)D→E的反应类型是___________________;K的结构简式是______________________。
(4)同时满足下列条件的G的同分异构体有________________种(不考虑立体异构)。
①含有碳碳三键
②遇FeCl3溶液发生显色反应
其中核磁共振氢谱为四组峰的结构简式为______________________。
(5)以乙醛为起始原料,选用必要的无机试剂合成1-丁烯,写出合成路线________________________________________________。
【答案】苯甲醛 碳碳双键、酯基 ![]() 取代反应(水解反应)
取代反应(水解反应) 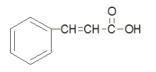 16
16 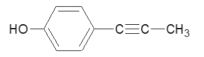
![]()
![]()
【解析】
烃A在标准状况下的密度为1.25g·L-1,则其摩尔质量为1.25g·L-1×22.4L·mol-1=28g·mol-1,则烃的分子式为C2H4,结构简式为CH2=CH2,A和水发生加成反应生成B,即乙醇,结构简式为CH3CH2OH,B在铜作催化剂的作用下,发生催化氧化,生成CH3CHO。甲苯和Cl2在光照下发生取代反应生成D,D在NaOH水溶液中发生水解反应,生成苯甲醇,结构简式为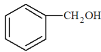 ;E在发生催化氧化生成F苯甲醛,结构简式为
;E在发生催化氧化生成F苯甲醛,结构简式为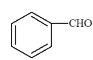 ;苯甲醛和乙醛发生已知②的反应,生成G。根据已知,G的结构简式为
;苯甲醛和乙醛发生已知②的反应,生成G。根据已知,G的结构简式为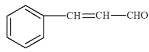 ,G发生银镜反应再酸化,-CHO转化为-COOH,K的结构简式为
,G发生银镜反应再酸化,-CHO转化为-COOH,K的结构简式为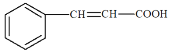 ,E苯甲醇,和K发生酯化反应得到M,其结构简式为
,E苯甲醇,和K发生酯化反应得到M,其结构简式为 。
。
(1)根据分析,F的结构简式为 ,名称为苯甲醛;M的结构简式为
,名称为苯甲醛;M的结构简式为 ,含有的官能团为酯基、碳碳双键;
,含有的官能团为酯基、碳碳双键;
(2)B→C为乙醇发生催化氧化生成乙醛,其化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)D→E为卤代烃在碱性条件下发生水解反应,也是取代反应;根据分析K的结构简式为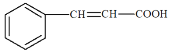 ;
;
(4)同时满足下列条件的G的同分异构体①含有碳碳三键,②遇FeCl3溶液发生显色反应,说明含有酚羟基。若三个碳原子,在一个取代基上,可能为-C≡C-CH3,或-CH2-C≡CH,与-OH,在苯环上有2×3=6种同分异构体;或者三个取代基,分别为-CH3、-OH、-C≡CH,3个不同的取代基,在苯环上有10种同分异构体;综上共16种;其中核磁共振氢谱为四组峰的结构简式为 ;
;
(5)乙醛中只有2个碳原子,而1-丁烯中有4个碳原子,利用已知②增长碳链,得到CH3CH=CHCHO,与氢气发生加成,得到CH3CH2CH2CH2OH,醇再消去得到目标产物,合成路线为CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH![]() CH3CH2CH=CH2。
CH3CH2CH=CH2。


科目:高中化学 来源: 题型:
【题目】通过对阳极泥的综合处理可以回收宝贵的金属,一种从铜阳极泥(主要成分为Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
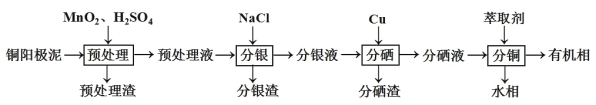
(1)已知预处理温度为80℃,预处理渣中几乎不含有单质S,则预处理时Cu2S发生反应的离子方程式为___。从环保角度来看,本工艺中采用稀H2SO4添加适量MnO2做预处理剂与传统工艺中采用浓硫酸作氧化剂相比的主要优点是___。
(2)回收分银渣中的银,可用如图过程:
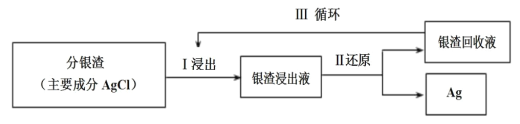
已知:S2O![]() -易与银离子发生络合反应:Ag++2S2O
-易与银离子发生络合反应:Ag++2S2O![]()
![]() Ag(S2O3)
Ag(S2O3)![]() 。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)
。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)![]() ]=
]=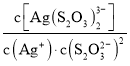 =2.8×1013,Ksp(AgCl)=1.8×10-10
=2.8×1013,Ksp(AgCl)=1.8×10-10
①Ⅰ中发生的离子反应方程式为:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
(aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
②Ⅲ中银渣回收液可直接循环使用,但循环多次后,银的浸出率会降低。从化学平衡的角度分析原因:___。
(3)分硒渣的主要成分是Cu2Se,可被氧化得到亚硒酸(H2SeO3)。已知常温下H2SeO3的Ka1=2.7×10-3,Ka2=2.5×10-8,则NaHSeO3溶液的pH___7(填“>”、“<”或“=”)。硒酸(H2SeO4)可以用氯水氧化亚硒酸得到,该反应化学方程式为___。
(4)分铜得到产品CuSO4·5H2O的具体操作如图:

其中萃取与反萃取原理为:2RH+Cu2+![]() R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A.v(H2)=0.2mol·L-1·min-1
B.v(N2)=0.2 mol·L-1·min-1
C.v(N2)=0.02 mol·L-1·s-1
D.v(H2)= 0.04 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】谷物中脂肪含量虽少,但却是其品质优劣的指标之一。黄玉米中粗脂肪(以亚油酸甘油酯为主)含量测定的实验流程如下:
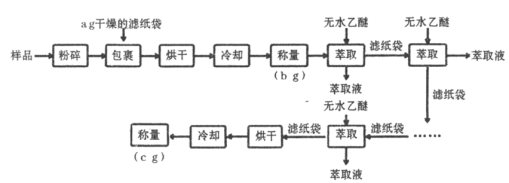
已知:亚油酸甘油酯沸点![]() ;乙醚熔点
;乙醚熔点![]() ,沸点
,沸点![]() ,易燃。
,易燃。
回答下列问题:
(1)实验中两次“冷却”均在干燥器中进行,其目的是____________________。
(2)上述实验中多次“萃取”均在下列____________仪器中进行(填字母标号)。
|
|
|
a | b | c |
(3)为了克服多次萃取实验操作繁琐,萃取剂消耗量过大的缺点, Franz von Soxhlet发明了索氏抽提筒。若将上述实验的多次萃取改为在下图装置中进行(约需10~12h):
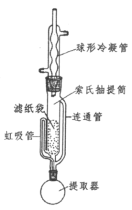
①为提高乙醚蒸气的冷凝效果,球形冷凝管可改用_____________(填仪器名称)。实验中常在冷凝管上口连接一个装有活性炭的球形干燥管,其目的是_______________。
②实验中需控制提取器(烧瓶)温度在60℃~70℃之间,应采取的加热方式是_____________________。
③索氏提取法原理:当无水乙醚加热沸腾后,蒸气通过____________(填字母标号,下同)上升,被冷凝为液体滴入抽提筒中,当液面超过________________________最高处时,萃取液即回流入提取器(烧瓶)中……如此往复。
a.冷凝管 b.虹吸管 c.连通管
④索氏提取法存在的明显缺点是__________________。
(4)数据处理:样品中纯脂肪百分含量_______________(填“<”、“>”或“=”)![]() ,原因是_______________________。
,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。

(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术。下列说法中不正确的是( )。
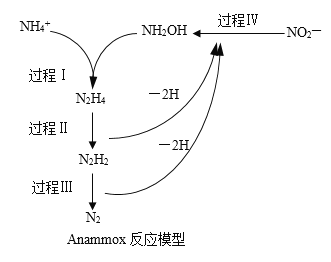
A.1mol![]() 所含的质子总数为10NA
所含的质子总数为10NA
B.联氨(N2H4)中含有极性键和非极性键
C.过程Ⅱ属于氧化反应,过程Ⅳ属于还原反应
D.过程Ⅰ中,参与反应的![]() 与NH2OH的物质的量之比为1:1
与NH2OH的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答问题:

(1)硬质玻璃管里发生反应的化学方程式为______。当三氧化二铬红热时,要移去酒精灯,原因是:______。
(2)圆底烧瓶里的实验现象是______,鼓入空气的作用是______。
(3)实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色______。
(4)实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式:______。
(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后______(填一种操作名称)。
(6)实验室里保存浓硝酸要用棕色瓶的原因是__________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有研究人员在体外实验中发现药物瑞德西韦对新冠病毒有明显抑制作用。![]() 是合成瑞德西韦的中间体,其合成路线如下:
是合成瑞德西韦的中间体,其合成路线如下:

回答下列问题:
(1)A的化学名称为________;反应④的反应类型为________。
(2)B中含氧官能团的名称为________;R的结构简式为________。
(3)写出反应②的化学方程式________。
(4)满足下列条件的B的同分异构体有________种(不包括立体异构)。
①苯的二取代物且苯环上含有硝基;②可以发生水解反应。
上述同分异构体中核磁共振氢谱为3:2:2的结构简式为________。
(5)结合题给信息和已学知识,设计由苯甲醛为原料制备 的合成路线(无机试剂任选)________。
的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用8.7g的MnO2与50mL足量的浓盐酸制取氯气,其反应方程式为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)求生成氯气的体积(标准状况)______________
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com