
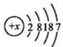
 、CaBr2:
、CaBr2: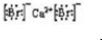 .
.分析 (1)由原子结构示意图,结合“核内质子数=核外电子数”,可计算出X的值;主族元素中,原子核外电子层数与其周期数相等,原子核外最外层电子数与其主族族序数相等;
(2)最外层7个电子,易得到1个电子形成最外层8电子稳定结构;得电子化合价降低的反应物是氧化剂,表现氧化性;
(3)最外层电子数=最高化合价数,据此书写最高价氧化物的水化物,最低化合价=最高化合价数-8;
(4)Cl、Br同主族,原子序数大的非金属性弱;
(5)溴化氢属于共价化合物,氢和溴之间存在一对共价键;溴化钙为离子化合物,电子式中需要标出阴阳离子所带电荷;
(6)溴单质氯与NaOH溶液反应生成溴化钠、次溴酸钠和水;
(7)氯气的氧化性比溴单质强,溴水只能氧化亚铁离子,不能氧化氯离子;
(8)Br的非金属性大于I;溴单质氧化碘离子;苯能萃取水中的碘,苯的密度小于水;
(9)乙烯中的官能团为双键,能够和溴加成,加成反应的特点是双键变单键,断键处加上加成试剂原子.
解答 解:(1)根据溴原子的结构示意图,结合核内质子数=核外电子数,则x=2+8+18+7=35;主族元素周期数=电子层数,主族族序数=最外层电子数,根据其原子结构示意图 知,该元素位于第4周期第ⅤⅡA族,
知,该元素位于第4周期第ⅤⅡA族,
故答案为:35;第4周期第ⅤⅡA族;
(2)最外层7个电子,易得到1个电子形成最外层8电子稳定结构,表现其氧化性,
故答案为:1;氧化性;
(3)最外层电子数=最高化合价数=+7,最低化合价=最高化合价数-8=7-8=-1,最高价为+7价,最高价氧化物的水化物为HBrO4,名称为高溴酸,
故答案为:-1;高溴酸;
(4)Cl、Br同主族,原子序数大的非金属性弱,则溴元素的非金属性比氯元素的非金属性弱,
故答案为:弱;
(5)溴化氢属于共价化合物,氢和溴之间存在一对共价键,电子式为: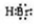 ,溴化钙为离子化合物,由溴离子和钙离子构成,电子式为:
,溴化钙为离子化合物,由溴离子和钙离子构成,电子式为: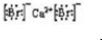 ,
,
故答案为: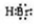 ;
;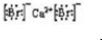 ;
;
(6)溴单质与NaOH溶液反应生成溴化钠、次溴酸钠和水,所以该反应的化学方程式为:Br2+2NaOH=NaBr+NaBrO+H2O,
故答案为:Br2+2NaOH=NaBr+NaBrO+H2O;
(7)将少量溴水滴加到FcC12溶液中,溴水只能氧化亚铁离子,离子反应为:2Fe2++Br2═2Fe3++2Br-,
故答案为:2Fe2++Br2═2Fe3++2Br-;
(8)向KI溶液中滴加少童溴水,溴能置换出碘,反应的离子方程式为:Br2+2I-=I2+2Br-,I2在苯中的溶解度远大于在水中的溶解度,所以发生萃取,苯的密度小于水,其现象是:溶液从无色变为紫色,并且分层,上层为紫色,下层无色,
故答案为:Br2+2I-=I2+2Br-;分层,上层为紫色,下层无色;
(9)乙烯和溴发生加成反应生成1,2-二溴乙烷,所以看到的现象是溶液褪色,反应方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:溴的四氯化碳溶液褪色;CH2=CH2+Br2→CH2BrCH2Br.
点评 本题考查溴原子及溴单质的性质,试题容量大,难度中等,注意对原子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系、注意溴单质的氧化性等知识点是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol | B. | 1.25 mol | C. | 1.6 mol | D. | 2.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2与少量NaOH溶液的反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 少量SO2通入NaClO溶液中:3ClO-+SO2+H2O═Cl-+SO42-+2HClO | |
| C. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O | |
| D. | NH4HSO4和少量Ba(OH)2溶液反应NH4++H++SO42-+Ba2++2OH-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va>10 Vb | B. | Vb=10Va | C. | Vb<10 Va | D. | Vb>10 Va |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物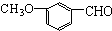 ,有多种同分异构体,其中属于酯且含有苯环结构的共有4种 ,有多种同分异构体,其中属于酯且含有苯环结构的共有4种 | |
| B. | 除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 | |
| C. | 甲酸分子中有醛基,因此无法区别甲醛溶液和甲酸溶液 | |
| D. | 苯乙烯分子中所有原子可能在一个平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com