
【题目】我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。
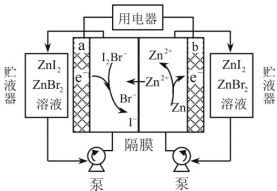
下列叙述不正确的是( )
A.放电时,a电极反应为I2Br-+2e- =2I-+ Br-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每减少0.65g,溶液中有0.02mol I-- 被氧化
D.充电时,a电极接外电源正极
【答案】C
【解析】
根据图像可知,放电时,b极,锌失电子生成锌离子,作电池的负极;a极I2Br-得电子生成溴离子和碘离子。
A. 放电时,a电极作正极,I2Br-得电子生成溴离子和碘离子,反应为I2Br-+2e- =2I-+ Br-,与题意不符,A错误;
B. 放电时,负极:Zn-2e-=Zn2+,正极:I2Br-+2e- =2I-+ Br-,溶液中离子的数目增大,与题意不符,B错误;
C. 充电时,b电极生成Zn,每增重0.65g,即生成0.01molZn,则转移0.02mol电子,阳极发生2I-+Br--2e-=I2Br-,溶液中有0.02molI-被氧化,故C正确;
D. 充电时,a电极作阳极,与外电源正极相连,与题意不符,D错误;
答案为C。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法其中正确的是( )
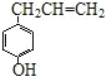
①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它存在能发生银镜反应的同分异构体;④1mol该化合物最多可与4mol H2发生加成反应
A.①③B.①②④C.②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中: Fe2+,NO3-,SO42-,Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+,K+,Cl-,HCO3-
C.![]() =1012的溶液中:NH4+,Al3+,NO3-,Cl-
=1012的溶液中:NH4+,Al3+,NO3-,Cl-
D.c(Fe3+) =0.1 mol·L-1的溶液中:K+,ClO-,SO42-,SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
A. 反应①和②均为氧化还原反应
B. 反应①的氧化剂是O2,还原剂是FeO·Cr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应①中每生成1 mol Na2CrO4时转移电子3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)![]() 2HI(g)已经达到平衡的标志是( )
2HI(g)已经达到平衡的标志是( )
A.HI的生成速率与HI的分解速率相等
B.HI的生成速率与H2的生成速率之比是2∶1
C.单位时间内一个H-H键断裂的同时有两个H-I键断裂
D.单位时间里断裂2nmolHI的同时生成nmolI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从冶铅废渣中提取铅的工艺流程如图所示:

已知:醋酸铅易溶于水,难电离。火法炼铅是将方铅矿(主要成分为PbS)在空气中焙烧,生成PbO和SO2。
回答下列问题:
(1)用方铅矿火法炼铅的反应的化学方程式为______。
(2)火法炼铅的废气中含SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____。
(3)冶铅废渣用硫酸洗涤后,生成的PbSO4表面常含有铜单质,为了溶解铜单质,常需要同时加入一定量的H2O2溶液,写出溶解铜单质发生反应的离子方程式_______;为加快此反应的速率,下列方法合理的是_____(填标号)。
A.搅拌 B.适当加热 C.减压
(4)将饱和Na2CO3溶液加入滤渣1中发生的反应为![]() (aq)+PbSO4(s)
(aq)+PbSO4(s)![]() PbCO3(s)+
PbCO3(s)+![]() (aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(5)工业上常用等体积的饱和NaHCO3溶液代替饱和Na2CO3溶液,将一定量的PbSO4转化为PbCO3。PbSO4与NaHCO3或Na2CO3的物质的量之比不同时,PbSO4的转化率如表所示。
Ⅰ | n(PbSO4)∶n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 98 | 98 | 98 |
依据表中数据,物质的量之比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬具有良好的解热、镇痛、抗炎、抗风湿作用 ,苯氧布洛芬的合成路线:
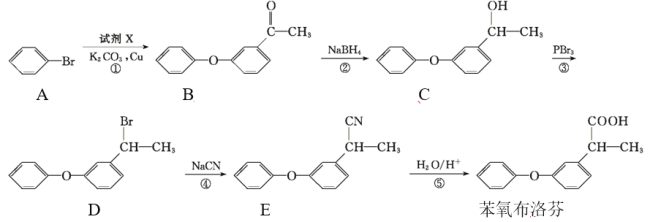
回答下列问题:
(1)苯氧布洛芬中官能团的名称为____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。A~D四种物质中,含有手性碳的有机物为____(填字母)。
(3)反应②的反应类型是____。
(4)若过程①发生的是取代反应,且另一种产物为HBr,由A生成B发生反应的化学方程式为____。
(5)有机物M与C互为同分异构体,M满足下列条件:
Ⅰ.能与FeCl3溶液发生显色反应,1 mol M可消耗2 mol NaOH;
Ⅱ.M分子中有6种不同化学环境的氢,核磁共振氢谱为3∶2∶2∶2∶2∶3,且分子中含有![]() 结构。
结构。
写出符合条件的M的一种结构简式:____。
(6)根据已有知识并结合相关信息,写出以丙酮(CH3COCH3)为原料制备2-甲基丙酸的合成路线流程图(无机试剂任用)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,该电极反应可能的机理如下图所示。下列说法正确的是
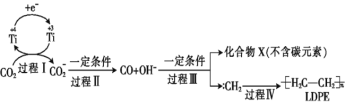
A. 含![]() 的-极与电源负极相连
的-极与电源负极相连
B. 过程Ⅰ、Ⅱ中碳元素均被还原,过程Ⅲ中碳元素被氧化
C. 电解过程中CO![]() 向阴极迁移
向阴极迁移
D. 工业上生产1.4×104 g的LDPE,转移电子的物质的量为6×103 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com