
| A. | 氧化反应 | B. | 取代反应 | C. | 加成反应 | D. | 消去反应 |
分析 该有机物含有羟基,可发生氧化反应、取代反应、消去反应,含有醛基,可发生加成和氧化反应,结合手性碳原子的定义解答该题;
解答 解:A.化合物CH3-CH2-CH(OH)-CH=CH2中羟基被氧化,得到化合物CH3-CH2-$\stackrel{\stackrel{O}{∥}}{C}$-CH=CH2,不含手性碳原子,故A不选;
B.化合物CH3-CH2-CH(OH)-CH=CH2中羟基与HBr发生取代反应,得到化合物CH3-CH2-CHBr-CH=CH2,含手性碳原子,故B选;
C.化合物CH3-CH2-CH(OH)-CH=CH2中 C=C与氢气发生加成反应,得到化合物CH3-CH2-CH(OH)-CH2CH3,不含手性碳原子,故C不选;
D.化合物CH3-CH2-CH(OH)-CH=CH2中羟基发生消去反应,得到化合物CH3-CH=CH-CH=CH2,不含手性碳原子,故D不选;
故选B.
点评 本题考查有机物的结构和性质,题目难度不大,注意把握手性碳原子的定义和官能团的性质为解答该题的关键.


科目:高中化学 来源: 题型:解答题
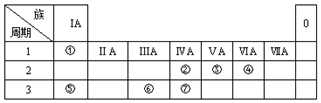
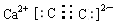 ,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3a}{2}$ mol | B. | $\frac{a}{18}$ mol | C. | $\frac{a}{27}$ mol | D. | $\frac{a}{96}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
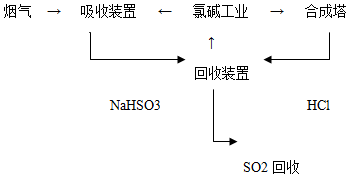
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2?Fe(SO2)63+(反应b) | I、制备Fe(OH)3胶体并检验 II、分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:Li+<O2-<F-<Na+ | B. | 电负性:F>N>O>C | ||
| C. | 分子中的键角:CO2>H2O>CH4>NH3 | D. | 共价键的键能:H-F>H-Cl>H-Br>H-I |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com