
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体.A、B、C、D、E、F和OPA的转化关系如下所示:
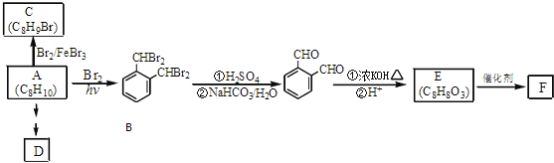
回答下列问题:
(1)A的化学名称是____________;
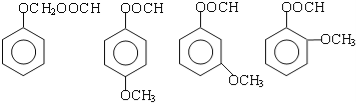
(2)由A生成B 的反应类型是____________,在该反应的副产物中,与B互为同分异构体的化合物的结构简式为____________;
(3)写出C所有可能的结构简式____________;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂.请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用结构简式表示合成路线____________;
(5)OPA的化学名称是____________,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为____________,该反应的化学方程式为____________;(提示![]() )
)
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式____________。
【答案】(1)邻二甲苯;
(2)取代反应,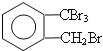 ;
;
(3)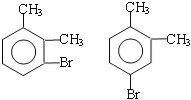 ;
;
(4)![]() ;
;
(5)邻苯二甲醛,缩聚反应,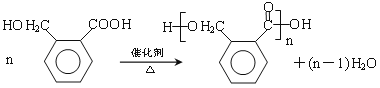 ;
;
(6)
【解析】试题分析:A和溴发生取代反应生成B,根据B的结构简式知,A是邻二甲苯,在溴化铁作催化剂条件下,邻二甲苯和溴发生取代反应生成C ,B发生一系列反应后生成邻苯二甲醛,结合已知条件知,邻苯二甲醛反应生成E,E的结构简式为
,B发生一系列反应后生成邻苯二甲醛,结合已知条件知,邻苯二甲醛反应生成E,E的结构简式为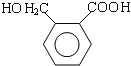 ,E发生缩聚反应生成F,F的结构简式为
,E发生缩聚反应生成F,F的结构简式为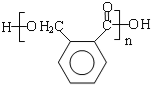 。
。
(1)A的结构简式为: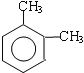 ,其名称是邻二甲苯,故答案为:邻二甲苯;
,其名称是邻二甲苯,故答案为:邻二甲苯;
(2)邻二甲苯和溴发生取代反应生成B,邻二甲苯的甲基上氢原子被溴原子取代生成溴代烃,在该反应的副产物中,与B互为同分异构体的化合物的结构简式为 ,故答案为:取代反应,
,故答案为:取代反应, ;
;
(3)在溴化铁作催化剂条件下,邻二甲苯和溴发生苯环上的取代反应,取代位置为甲基的邻、对位,所以C可能的结构简式为: ,故答案为:
,故答案为: ;
;
(4)酸性条件下,邻二甲苯被高锰酸钾氧化生成邻苯二甲酸,在浓硫酸、加热条件下,邻苯二甲酸和乙醇发生酯化反应生成邻苯二甲酸二乙酯,故答案为:![]() ;
;
(5)OPA的化学名称是邻苯二甲醛,E发生缩聚反应生成F,该反应方程式为: ,故答案为:邻苯二甲醛,缩聚反应,
,故答案为:邻苯二甲醛,缩聚反应, ;
;
(6)E的结构简式为 ,芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,则G的结构简式可能为:
,芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,则G的结构简式可能为: ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍.请填写下列空格:
(1)请写出A的元素符号______;
(2)C的阴离子的结构示意图______;
(3)C、D两元素形成的化合物的电子式__________________________。
(4)A、B两元素相比较,A元素的活泼性较强,可以验证该结论的实验是( )
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性.
(5)写出D的氢化物与C的单质1:2反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学~选修2:化学与技术]
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素。从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害。下图是用高炉烟尘制取硫酸锌的工业流程。

已知:①20℃时,0.1 mol.L-1的金属离子沉淀时的pH

②过二硫酸铵是一种强氧化剂。
![]()
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种) 。
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是 。
(3)加入MnO2的目的是 。
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式 。
(5)写出还原过程发生的主要反应的离子方程式 。
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是 。
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1) 3,3-二甲基-4-乙基庚烷
结构简式为_______________________________________。
(2)3-甲基-2-乙基-1-戊烯
结构简式为________________________________________。
(3)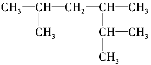
名称为_______________________________________。
(4)![]()
名称为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΔH>0
CO2(g)+3H2(g) ΔH>0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)________。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为a L。试回答:
①反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为________;A、B两容器中H2O(g)的体积百分含量的大小关系为:B________A(填“>”“<”或“=”)。
②若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A 气体和2 mol B 气体在2 L 的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)![]() 2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
A. 当A、B、C物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B. 4s内用物质B表示的反应速率为0.075 mol·L-1·s-1
C. 达平衡后若通入一定量氦气,A的转化率降低
D. 达平衡后若升高温度,C的浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.利用N2和H2合成氨,目前工业的生产条件为:催化剂(铁触媒),温度(400~500℃),压强(30~50MPa),如图为流程示意图:
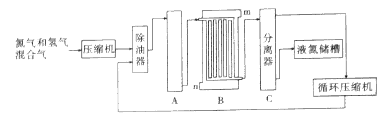
请回答下列问题:
(1)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是__________,__________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式__________,__________;
(2)设备A中含有电加热器、铁触煤和热交换器,设备A的名称__________,其中发生的化学反应方程式为__________;实际生产中采用400~500℃的高温,原因之一是__________,原因之二是__________。
(3)设备B的名称__________,其中m和n是两个通水口,入水口是__________(填“m”或“n”).不宜从相反方向通水的原因是__________;
(4)设备C的作用__________;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)![]() CO2(g)+H2(g),已知1000K时该反应的平衡常数K=1,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于__________。
CO2(g)+H2(g),已知1000K时该反应的平衡常数K=1,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】
NaCl是价廉且应用广泛的化工业原料,例如应用于纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等。
(1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,20世纪20年代以后被联合制碱法逐渐取代。
①请写出以NaCl为原料利用氨碱法生产纯碱的化学方程式_____________________。
②在联合制碱法中,纯碱工厂与______________工厂进行联合生产,以方便的获得原料_________________。
③在联合制碱法中循环使用,而在氨碱法中循环使用率不高的物质是_______________。
(2)氯酸钾是重要的化工业产品,在火柴、炸药、雷管、焰火等制造中有重要应用,工业中首先通过电解热食盐水制得氯酸钠,再加入一定量的氯化钾即可得到氯酸钾沉淀。
①在火柴、炸药、雷管、焰火的制造过程中大量使用氯酸钾,主要应用氯酸钾的___________性。
②请写出电解食盐水生产氯酸钠的化学方程式__________________。该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有____________________(请答出两点)。
(3)在肥皂的工业生成过程中,也要使用NaCl的目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3 = Na2CO3 + CO2↑+ H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
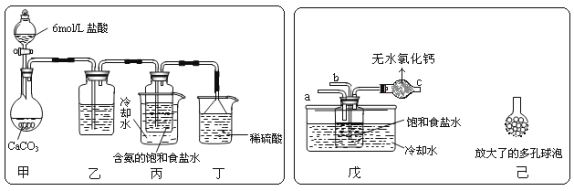
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 .
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com