
| A. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| B. | 标准状况下,2.24L NO与11.2L O2混合后气体的分子数小于NA | |
| C. | 120g熔融的NaHSO4中含阳离子总数为2NA | |
| D. | 用5mL 3mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015NA |
分析 A、依据碳酸钠水解显碱性,结合溶液中离子积常数计算分析,溶液体积不知不能计算微粒数;
B.由2NO+O2═2NO2,2NO2?N2O4,利用气体的物质的量来分析分子总数;
C.熔融的NaHSO4中含有的阳离子只有钠离子;
D.一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、25℃,pH=11的Na2CO3溶液中存在离子积常数,[H+]余=10-11mol/L;[H+]余•[OH-]水=10-14 ;由水电离出的[H+]=[OH-]=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L;溶液体积不知,由水电离出的氢离子的数目无法计算,故A错误;
B.标准状况下,22.4LNO和11.2L氧气的物质的量分别为1mol、0.5mol,由2NO+O2═2NO2、2NO2?N2O4,则气体的分子总数小于NA个,故B正确;
C.120g熔融的NaHSO4的物质的量为1mol,1mol熔融硫酸氢钠电离出1mol钠离子和1mol硫酸氢根离子,所以含有的阳离子数为NA,故C错误;
D.一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故所含胶粒的个数小于0.015NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,题目难度中等,应注意公式的运用和物质的结构特点,掌握基础是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
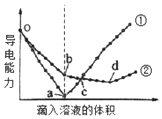 在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | o-b段,发生的离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | bd段,发生的离子方程式:OH-+H+═H2O | |
| C. | c点,两溶液中阴、阳离子的浓度之和相等 | |
| D. | o-a段加入溶液的体积为20mL,则NaHSO4溶液的浓度为0.75mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 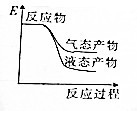 | B. | 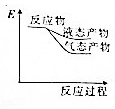 | C. | 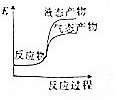 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤 | B. | 蒸发 | C. | 分液 | D. | 分馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
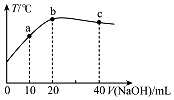 在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,此时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) | |
| B. | B.从a到b:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | 溶液的pH值:a点<c点<b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
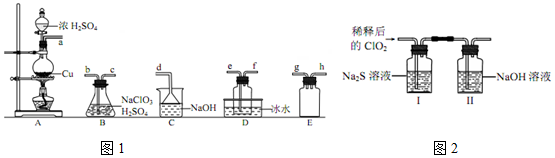
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无SO2(或HSO3-或SO32-)生成 |
| 另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42-生成 |
| ③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙内 加入足量稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | 有Cl-生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com