
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3—等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
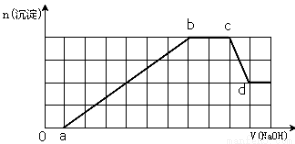
A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B.ab段发生的离子反应为:Al3++3OH—= Al(OH)3↓,Mg2++2OH—= Mg(OH)2↓
C.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+
D.d点溶液中含有的溶质只有Na2SO4
A
【解析】
试题分析:加入0-a段,加入氢氧化钠溶液后没有生成沉淀,说明溶液中一定存在氢离子或碳酸氢根离子,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在铝离子,所以一定不存在碳酸氢根离子,因此一定存在氢离子;a-b段生成沉淀消耗了6体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,根据c-d段部分沉淀溶解,可知一定存在Al3+,根据图象氢氧化铝沉淀的物质的量与剩余的沉淀的物质的量相等,由OH-~AlO2-可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3体积氢氧化钠,另一种离子生成的沉淀的量与消耗的氢氧化钠与铝离子相同,说明另一种离子为+3价离子,只能为铁离子,故原溶液中一定不存在镁离子;再由b-c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在铵离子;再根据溶液呈电中性可知,溶液中一定存在硫酸根离子。A、根据图象可知生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解消耗了1体积的氢氧化钠,所以生成氢氧化铝需要消耗3体积的NaOH溶液,还有3体积的NaOH溶液一定是被Fe3+消耗,即铁离子与铝离子消耗的氢氧化钠溶液的体积相同,故原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故A正确;B、根据以上分析可知,ab段发生的离子反应为铁离子、铝离子与氢氧根离子的反应,反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,故B错误;C、原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,一定不存在镁离子,可能存在钠离子,故C错误;D、d点氢氧化铝与氢氧化钠溶液恰好完全反应生成偏铝酸钠,所以溶液中含有的溶质为Na2SO4、NaAlO2,故D错误。
考点:本题考查离子反应及应用,图像的分析。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.铜片加入稀硝酸中:3Cu +2NO3- + 8H+==3Cu2+ + 2NO↑ + 4H2O
B.向小苏打溶液中加入醋酸:HCO3-+ H+=CO2↑+H2O
C.向HI溶液中加入Fe(OH)3固体:Fe(OH)3+3H+=Fe3++3H2O
D.向MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO4 2-= BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:填空题
(15分)A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图 ,E元素在周期表中的位置是 。
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为 。
(3)D与C按原子个数比为1:1形成化合物的电子式是 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 (填具体的化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的化合物甲反应的离子方程式 。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中H+移向 (填“正”或“负”)极。
(7) E(s)+O2(g) EO2(g) △H1 E(g)+O2(g) EO2(g) △H2,
则△Hl △H2(填“>”或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
下列各组物质的性质比较,正确的是
A.稳定性:H2O<NH3<PH3<SiH4
B.熔点:CO2<H2O<SiO2<KCl
C.酸性:HClO4>H3PO4>H2SO4>H2SiO3
D.粒子半径:K+>Na+>Mg2+>Al3+
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
下列各组离子在对应溶液中可能大量存在的是
A.水电离出的c(H+)=10-12 mol·L-1的溶液:K+、Cu2+、SO32-、MnO4-
B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl-
C.含有大量ClO-的溶液:H+、I-、SO42-、Cl-
D.pH=12的溶液:K+、Cl-、SO32-、SiO32-
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
二氯化二硫(S2C12)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结
构与H2O2相似,熔点为193 K,沸点为411K,遇水很容易反应,产生的气体能使品红褪色,
S2C12可由干燥的氯气通入熔融的硫中制得。下列有关说法不正确的是
A.S2C12晶体中不存在离子键
B.S2C12分子中各原子均达到8电子稳定结构
C.S2C12在液态下不能导电
D.制备S2C12的反应是化合反应,不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:填空题
(每空2分,共12分)
PCl3与PCl5均是有机合成的重要中间体,两者存在以下相互转化关系:
PCl5(g)  PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
2L真空密闭容器中发生上述反应,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 |
n(PCl5) | 4 | 2.8 | 2 | 2 |
(1)已知上述反应在温度较高时才能自发进行,则a 0(填﹥、﹦、﹤);
(2)计算从20s至40s共20s的时间内,用PCl3表示的平均反应速率为 。210℃时该反应的平衡常数K值等于 。
(3)反应进行至60s后,将混合物的温度降低,重新达到平衡后氯气浓度将 (填“增大”、“减少”或“不变”)。
(4)欲增大该反应的K值,可采取的措施有(填序号)
A.降低温度 B.向混合气体中通入Cl2
C.使用高效催化剂 D.升高温度
(5)如右图是210℃时容器中PCl5物质的量的变化曲线,请在该图中补画出该反应在160℃时PCl5物质的量的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍。下列说法不正确的是
A.N的单质的晶体属于金属晶体;U的氢化物的球棍模型示意图为
B.工业上V的单质的制备可以电解熔融的NV
C.Z的最高价氧化物对应的水化物能与其气态氢化物反应生成盐
D.X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物;也可形成结构式为X—W—Y ≡ Z的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com