
| A、Fe(NO3)3溶液中加入过量的HI溶液的反应为:2Fe3++2I-═2Fe2++I2 |
| B、在氨水中通入过量SO2的反应为:2NH3?H2O+SO2═2NH4++SO32-+H2O |
| C、将足量CO2通入含Cl-、CO32-、NO3-、NH4+的溶液中无明显现象 |
| D、碱性溶液中,Na+、Ba2+、ClO-、SO32-可以大量共存 |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| A、改用18.4mol?L-1的硫酸 |
| B、增加Fe的质量 |
| C、滴加几滴CuSO4溶液 |
| D、降低稀硫酸的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
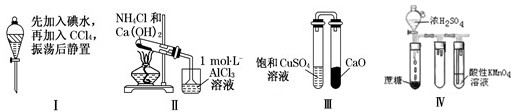
| A、实验Ⅰ:液体分层,下层呈无色 |
| B、实验Ⅱ:烧杯中先后出现白色沉淀,后溶解 |
| C、实验Ⅲ:一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
| D、实验Ⅳ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
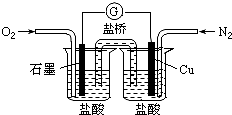 下列是某校实验小组设计的一套原电池装置,下列有关描述不正确的是( )
下列是某校实验小组设计的一套原电池装置,下列有关描述不正确的是( )| A、此装置能将化学能转变为电能 |
| B、石墨电极的反应式:O2+2H2O+4e-=4OH- |
| C、电子由Cu电极经导线流向石墨电极 |
| D、电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向胶体中加入蔗糖溶液,产生聚沉现象 |
| B、可见光透过胶体时,发生丁达尔现象 |
| C、用渗析的方法“净化”胶体时,使用的半透膜只能让分子、离子通过 |
| D、胶体能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水 | B、氢氧化镁 |
| C、碳酸钠 | D、碳酸镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
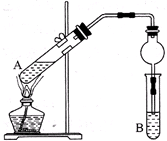 用如图所示实验装置制取乙酸乙酯.回答以下问题:
用如图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com