
某蓄电池放电、充电时的反应为
Fe+Ni2O3+3H2O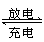
 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是Fe(OH)2+2e-===Fe+2OH- ③充电时,Ni(OH)2为阳极 ④蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.①②④ C.①③④ D.②③④
D
解析 蓄电池在放电时发生原电池反应,把化学能转变为电能;在充电时发生电解反应,将电能转变为化学能。反应方程式的左右各物质互为反应物和生成物。
此蓄电池在放电时的反应:+2O3+3H2O (OH)2+2 (OH)2,生成物为Fe(OH)2、Ni(OH)2,电解质溶液应为碱性溶液。Fe为负极,其电极反应式为Fe+2OH--2e-===Fe(OH)2;Ni2O3为正极,其电极反应式为Ni2O3+2e-+3H2O===2Ni(OH)2+2OH-;蓄电池在充电时的反应:Fe(OH)2+2Ni(OH)2Fe+Ni2O3+3H2O;阳极Ni(OH)2发生氧化反应:2Ni(OH)2+2OH--2e-===Ni2O3+3H2O;阴极Fe(OH)2发生还原反应:Fe(OH)2+2e-===Fe+2OH-。


科目:高中化学 来源: 题型:
下表所列物质晶体的类型全部正确的一组是 ( )。
| 原子晶体 | 离子晶体 | 分子晶体 | |
| A | 氮化硅 | 磷酸 | 单质硫 |
| B | 单晶硅 | 氯化铝 | 白磷 |
| C | 金刚石 | 烧碱 | 冰 |
| D | 铁 | 尿素 | 冰醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)⇋2HI(g)。
(1)反应刚开始时,由于c(H2)=_______,c(I2)=_______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
(3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
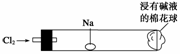
“绿色化学实验”进课堂,某化学老师为“氯气与金属钠反应”设计了如右图所示装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆大的金属钠(已擦净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉花球是用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.若在棉花球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式为:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式为:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项与化学平衡移动原理无关的是 ( )。
A.收集氯气用排饱和食盐水的方法
B.加催化剂,使N2和H2在一定的条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.加压条件下有利于SO2和O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是 ( )。
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于
Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
聚乙酸乙烯酯广泛用于制备涂料、粘合剂等,它和高聚物长的合成路线如下;,
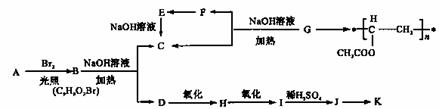
其中J物质与氯化铁溶液能发生显色反应,且苯环上的一元取代物有两种。
已知 当羟基与双键碳原子相连时,易发生如下转化RCH =CHOH→RCH2CHO
当羟基与双键碳原子相连时,易发生如下转化RCH =CHOH→RCH2CHO
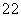 一ONa连在烃基生不会被氧化
一ONa连在烃基生不会被氧化
请回答下列问题:
(1)写出G的结构简式 。F与H中具有相同官能团的名称 。
(2)上述变化中G→C+F 的反应类型是 ;J在-定条件下能生成高聚物K,K的结构简式是
(3)写出B→C+D反应的化学方程式: 。
(4)同时符合下列要求的A的同分异构体有 种。
I含有苯环 II能发生银镜反应和水解反应
并写出满足下列条件的同分异构体结构简式: 。
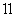 核磁共振氢谱有5 个吸收峰;
核磁共振氢谱有5 个吸收峰;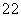 1mol该同分异构体能与Imol NaOH 反应
1mol该同分异构体能与Imol NaOH 反应
(5)下列有关说法正确的是 。
A.1 mol A 完全燃烧消耗10.5 mol O2
b.J与足量的碳酸氢钠溶液反应能生成相应的二钠盐·
c.D→H 的试剂通常是KMO4 酸性溶液
d.J能发生加成、消去、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A—I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中σ与π键数目比为 B、C、D第一电离能由小到大的顺序为 (填写元素符号)
 (2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
(2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
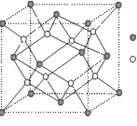
(3)D与G可以形成右图的晶胞,则黑点表示的是 元素(填写元素符号),该元素原子在该晶胞中的配位数为
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的元素更改为另外两种元素,则这个晶胞化学式为 ,若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,该晶胞中成键原子键角为 。
(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为 如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为 。(阿伏加德罗常数用NA表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com