
| A.一定条件下,使用催化剂能加快反应速率但不能改变平衡转化率 |
| B.氢氧燃料电池的能量转换形式仅为化学能转化为电能 |
| C.在NH4HSO4溶液中由于NH4+的水解促进了水的电离,所以水的电离程度增大 |
D.在一密闭容器中发生2SO2+O2 2SO3反应,增大压强,平衡会正向移动, 2SO3反应,增大压强,平衡会正向移动,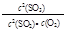 的值增大 的值增大 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在潮湿的空气中,马口铁和白铁皮镀层受损后,铁都比受损前更容易生锈 |
| B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的ΔH<0 |
C.反应N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零): |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
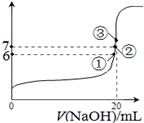
 SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



| A.降低温度 | B.增加了生成物 | C.减小压强 | D.使用了高效催化剂 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 |
| D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 1/2N2O4(g) △H =-26.35 kJ·mol-1
1/2N2O4(g) △H =-26.35 kJ·mol-1 2NH3(g) △H<0的影响如图所示。
2NH3(g) △H<0的影响如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是 | 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
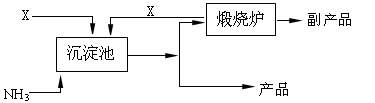
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com