
�����������գ�
��1����SO2��SO3�з��Ӹ�����Ϊ1��1 ʱ��ԭ������֮��Ϊ ������֮��Ϊ ��
��2���кͺ�0.2 mol HCl��ϡ���ᣬ��NaOH������Ϊ g��
��3������m gij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪM g��mol��1 ����
�ٸ���������ʵ���Ϊ mol��
�ڸ������ڱ�״���µ����Ϊ L��
�۸���������ˮ���γ�V L��Һ�������Ƿ�Ӧ��������Һ�����ʵ���Ũ��Ϊ mol��L��1��
��4����5 mol/L��Mg(NO3)2��Һa mLϡ����b mL��ϡ�ͺ���Һ��NO3�������ʵ���Ũ���� mol��L��1��
��5���õ������0.1 mol��L��1��BaCl2 ��Һ����ʹ��ͬ�����Fe2(SO4)3��Na2SO4��KAl(SO4)2 ������Һ�е�SO42����ȫ�����������������ε����ʵ���Ũ��֮��Ϊ ��
��12�֣�
��1��3��4 4��5 ��2��8 ��3����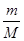 ��
��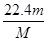 ��
��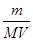 ��4��10a/b mol/L ��5��2��6��3
��4��10a/b mol/L ��5��2��6��3
��������
�����������1������SO2��SO3�з��Ӹ�����Ϊx��������������ԭ������֮��Ϊ(x+2x)��(x+3x)=3��4������n=N/NA�������ǵ����ʵ���֮��Ϊ1��1 �����Ϊymol������m=n•M�������ǵ�����֮��Ϊ(64y)��(80y)=4��5����2�������������������кͷ�ӦʽΪNaOH+HCl=NaCl+H2O����������Ӧ��Ļ�ѧ������֮�ȵ������ʵ���֮�ȣ�������NaOH�����ʵ���Ϊ0.2mol������m=n•M����NaOH������Ϊ0.2mol��40g/mol=8g����3����������n=m/M�������������ʵ���Ϊ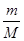 mol��������V=n��22.4L/mol�������������Ϊ
mol��������V=n��22.4L/mol�������������Ϊ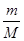 mol��22.4L/mol=
mol��22.4L/mol=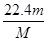 L��������c=n/V����������ܽ�������Һ�����ʵ����ʵ���Ũ��Ϊ
L��������c=n/V����������ܽ�������Һ�����ʵ����ʵ���Ũ��Ϊ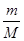 mol��VL=
mol��VL=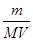 mol/L����4����ϡ�Ͷ��ɿ�֪��ϡ��ǰ������þ�����ʵ�����ȣ�c1•V1=c2•V2����ϡ�ͺ�����þ�����ʵ���Ũ��Ϊ5a/bmol/L������þ�ĵ��뷽��ʽΪMg(NO3)2=Mg2++2NO3�����������뷴Ӧ��Ļ�ѧ������֮�ȵ������ʵ���֮�ȣ���ϡ�ͺ����������Ũ��Ϊ10a/bmol/L����5����������Ӧʽ��ΪBa2++SO42��=BaSO4��������Ӧ��Ļ�ѧ������֮�ȵ������ʵ���֮�ȣ���������Ӧ���ĵ��Ȼ�����ͬ����Ba2+��SO42����Ϊxmol�����ֿ����������εĵ��뷽��ʽΪ��Fe2(SO4)3=2Fe3++3SO42����Na2SO4=2Na++SO42����KAl(SO4)2=K++Al3++2SO42�������з�Ӧ�����������ӵĻ�ѧ������֮�ȵ������ʵ���֮�ȣ������ĵ�Fe2(SO4)3��Na2SO4��KAl(SO4)2 �ֱ�Ϊx/3mol��xmol��x/2mol������������������Һ�����ͬ��c=n/V����Fe2(SO4)3��Na2SO4��KAl(SO4)2�����ʵ���Ũ��֮��Ϊx/3��x��x/2=2��6��3��
mol/L����4����ϡ�Ͷ��ɿ�֪��ϡ��ǰ������þ�����ʵ�����ȣ�c1•V1=c2•V2����ϡ�ͺ�����þ�����ʵ���Ũ��Ϊ5a/bmol/L������þ�ĵ��뷽��ʽΪMg(NO3)2=Mg2++2NO3�����������뷴Ӧ��Ļ�ѧ������֮�ȵ������ʵ���֮�ȣ���ϡ�ͺ����������Ũ��Ϊ10a/bmol/L����5����������Ӧʽ��ΪBa2++SO42��=BaSO4��������Ӧ��Ļ�ѧ������֮�ȵ������ʵ���֮�ȣ���������Ӧ���ĵ��Ȼ�����ͬ����Ba2+��SO42����Ϊxmol�����ֿ����������εĵ��뷽��ʽΪ��Fe2(SO4)3=2Fe3++3SO42����Na2SO4=2Na++SO42����KAl(SO4)2=K++Al3++2SO42�������з�Ӧ�����������ӵĻ�ѧ������֮�ȵ������ʵ���֮�ȣ������ĵ�Fe2(SO4)3��Na2SO4��KAl(SO4)2 �ֱ�Ϊx/3mol��xmol��x/2mol������������������Һ�����ͬ��c=n/V����Fe2(SO4)3��Na2SO4��KAl(SO4)2�����ʵ���Ũ��֮��Ϊx/3��x��x/2=2��6��3��
���㣺�������ʵ�����������Ħ����������������������������Ħ����������ʵ���Ũ�ȡ�ϡ�Ͷ��ɡ����ʵ����ڻ�ѧ����ʽ�����뷽��ʽ�����е�Ӧ�õ����֪ʶ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飺�����������գ�
ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飺�����������գ�| ʵ���� | NaOH��Һ��Ũ�� ��mol/L�� |
�ζ����ʱ��NaOH��Һ����������mL�� | ����������Һ����� ��mL�� |
| 1 | 0.1000 | 22.62 | 20.00 |
| 2 | 0.1000 | 22.72 | 20.00 |
| 3 | 0.1000 | 22.80 | 20.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
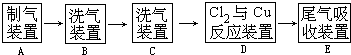
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 10a |
| b |
| 10a |
| b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
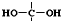 �� ���ȶ��� �ڷ����в����ڹ����� ��-O-O-����
�� ���ȶ��� �ڷ����в����ڹ����� ��-O-O-����| ʵ��ԭ�� | Ԥ������H2���������״���� | ��ӦX�Ľṹ��ʽ | ȡ6.2gX�������Ʒ�Ӧ��ͨ�����������������ȷ��X��������������Ʒ�Ӧ����ԭ����Ŀ������ȷ��X�Ľṹ |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com