
| A. | ①⑤⑦ | B. | ②④⑥ | C. | ③⑦⑧ | D. | ③⑥⑦⑧ |
分析 产生氢气的量不变,则保证铁完全与盐酸反应;增大盐酸的浓度、升高温度、形成原电池、增大Fe与盐酸的接触面积都可以加快化学反应速率,据此分析.
解答 解:①加水,稀释了盐酸,故反应速率变慢,故不选;
②加入氢氧化钠会消耗盐酸,盐酸浓度降低,和金属锌反应速率减慢,故不选;
③加浓盐酸,盐酸浓度增大,反应速率加快,故选;
④加CuO固体会消耗盐酸,盐酸浓度降低,和金属锌反应速率减慢,故不选;
⑤加氯化钠固体,对反应速率无影响,故不选;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量,故不选;
⑦升高温度,反应速率加快,故选;
⑧改用浓度大的盐酸,反应速率加快,故选;
故选C.
点评 本题考查了影响反应速率的因素.审题时要注意:加快反应速率和不改变氢气的量.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
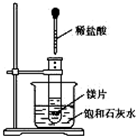 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸,试完成下列问题.
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸,试完成下列问题. 、
、 、
、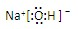 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素的性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为固态,其氢化物的化学式为RH4 |
| Z | 第三周期的简单离子中半径最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和CO2属于分子晶体 | |
| B. | CO2和CH4分子中含有极性共价键,但都是非极性分子 | |
| C. | 因为碳氢键键能小于碳氧双键,所以CH4熔点低于CO2 | |
| D. | CH4和CO2分子中碳原子的杂化类型分别是sp3和sp |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子通式为CnH2n+2的两烷烃一定互为同系物 | |
| B. | 卤代烃发生水解反应一定生成醇 | |
| C. | 苯和甲苯都能被酸性KMnO4溶液氧化 | |
| D. | 烃类都能燃烧生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 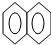 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$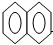 -NO2+H2O -NO2+H2O | |
| B. | CH3CH2CH2CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | (CH3)2CHCH=CH2+HI→(CH3)2CHCHICH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com