
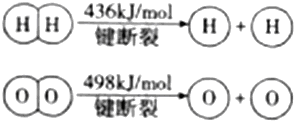
| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1mol H-O键需要的能量是926.8kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol | |
| D. | H2(g)中的H-H键比H2O(g)中的H-O键能小 |
分析 A.根据自发进行的氧化还原反应可以设计成原电池反应;
B.根据反应热等于反应物的总键能-生成物的总键能来求解;
C.根据反应热与物质的量成正比以及反应逆向进行,反应热大小不变,符号相反;
D.根据键能越大越牢固.
解答 解:A.2H2(g)+O2(g)?2H2O是自发进行的氧化还原反应,可以设计氢氧燃料电池,故A正确;
B.2H2(g)+O2(g)?2H2O(g)的反应热△H=反应物的总键能-生成物的总键能=436kJ•mol-1×2+498kJ•mol-1-4×XkJ•mol-1=-483.6kJ/mol,解得X=463.4kJ•mol-1,所以破坏1molH-O键需要的能量是463.4kJ,故B错误;
C.反应热与物质的量成正比,所以H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H=-241.8kJ/mol,反应逆向进行,反应热大小不变,符号相反,所以H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol,故C正确;
D.H2(g)中的H-H键键能为436kJ•mol-1,H2O(g)中的H-O键键为463.4kJ•mol-1,所以H2O(g)中的H-O键比H2(g)中的H-H键大,故D正确;
故选B.
点评 本题主要考查了反应热的计算,难度不大,需要注意的是反应热等于反应物的总键能-生成物的总键能,键能越大越牢固.


 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5mo1 C2H4 | B. | 11.2L(标准状况) C2H2 气体 | ||
| C. | 23g Na | D. | 9g H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20g | B. | 25.4g | C. | 31.6g | D. | 34.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
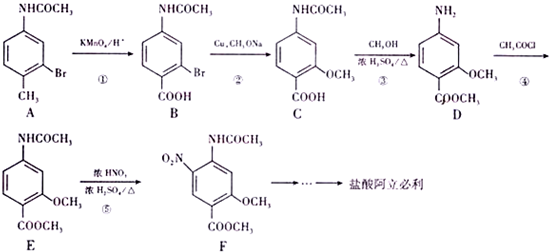
 .
.
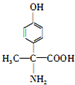
 (该物质易被氧化).请写出以
(该物质易被氧化).请写出以 、CH3COCl、CH3OH为原料制备
、CH3COCl、CH3OH为原料制备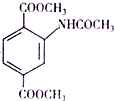 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C═CH2$\stackrel{Hr_{2}}{→}$
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C═CH2$\stackrel{Hr_{2}}{→}$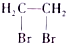
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
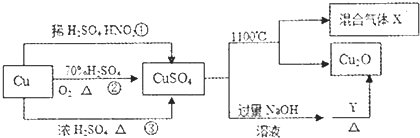
| A. | 途径①、②和③都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是甲醛溶液 | |
| C. | CuSO.在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,因Cu2+水解得不到胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学造成环境污染和严重事故,有媒体打出“我们恨化学”的广告是有道理的 | |
| B. | 易燃物钠、镁着火,若及早发现,消防员可以用高压水枪将其浇灭 | |
| C. | 对危险化工品应贴上相应的危险化学品标志,其中标志上的数字表示危险等级 | |
| D. | 对含剧毒物NaCN的废水,防化部队用H2O2使之氧化,使用双氧水处理现场前,应紧急疏散群众 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 1L0.1mol/L该溶液和足量的Cu充分反应,离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 蒸馏、过滤、分液、蒸发 | B. | 蒸馏、蒸发、分液、过滤 | ||
| C. | 分液、过滤、蒸馏、蒸发 | D. | 过滤、蒸发、分液、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com