


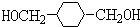 .
.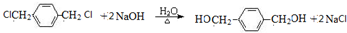 .
. .
. 分析 PX属于烃类,PX被酸性高锰酸钾氧化应该生成羧酸,根据P结构简式,可知F为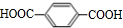 、N为
、N为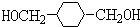 则PX为
则PX为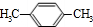 ,PX反应生成G,G能和NaOH的水溶液在加热条件下反应,则G为卤代烃,G水解后生成醇M,M结构简式为
,PX反应生成G,G能和NaOH的水溶液在加热条件下反应,则G为卤代烃,G水解后生成醇M,M结构简式为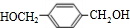 ,M与氢气发生加成反应生成N,对二甲苯可以在光照条件下与氯气发生取代反应生成G为
,M与氢气发生加成反应生成N,对二甲苯可以在光照条件下与氯气发生取代反应生成G为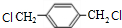 .PX和溴发生取代反应生成A,A发生信息中的反应得到B,根据A分子式可知A结构简式为
.PX和溴发生取代反应生成A,A发生信息中的反应得到B,根据A分子式可知A结构简式为 ,B为
,B为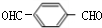 ,根据B、D分子式,结合信息可知D为
,根据B、D分子式,结合信息可知D为 ,D发生缩聚反应生成高分子化合物E,E结构简式为
,D发生缩聚反应生成高分子化合物E,E结构简式为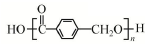 .
.
解答 解:PX属于烃类,PX被酸性高锰酸钾氧化应该生成羧酸,根据P结构简式,可知F为 、N为
、N为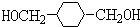 则PX为
则PX为 ,PX反应生成G,G能和NaOH的水溶液在加热条件下反应,则G为卤代烃,G水解后生成醇M,M结构简式为
,PX反应生成G,G能和NaOH的水溶液在加热条件下反应,则G为卤代烃,G水解后生成醇M,M结构简式为 ,M与氢气发生加成反应生成N,对二甲苯可以在光照条件下与氯气发生取代反应生成G为
,M与氢气发生加成反应生成N,对二甲苯可以在光照条件下与氯气发生取代反应生成G为 .PX和溴发生取代反应生成A,A发生信息中的反应得到B,根据A分子式可知A结构简式为
.PX和溴发生取代反应生成A,A发生信息中的反应得到B,根据A分子式可知A结构简式为 ,B为
,B为 ,根据B、D分子式,结合信息可知D为
,根据B、D分子式,结合信息可知D为 ,D发生缩聚反应生成高分子化合物E,E结构简式为
,D发生缩聚反应生成高分子化合物E,E结构简式为 .
.
(1)B为 ,含有的官能团名称是醛基,苯环上含有1种H原子,则B中苯环上的一氯代物有1种,
,含有的官能团名称是醛基,苯环上含有1种H原子,则B中苯环上的一氯代物有1种,
故答案为:醛基;1;
(2)N的结构简式是: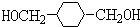 ,故答案为:
,故答案为: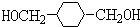 ;
;
(3)G→M的方程式为: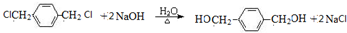 ,
,
故答案为: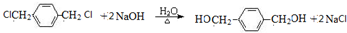 ;
;
(4)根据p的结构简式可知,1分子p中酯基的数目为 2n-1,故答案为:2n-1;
(5)D可发生缩聚反应生成E,其化学方程式是 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用P的结构、有机物分子式与给予的信息进行推断,关键是对信息的理解,熟练掌握官能团的性质与转化,侧重考查学生分析推断能力、信息获取与知识迁移运用能力.


科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高反应体系的温度,可使反应速率变大 | |
| B. | 该反应中N2不可能100%转化为NH3 | |
| C. | 该反应达到平衡状态时,N2、H2和NH3三者的浓度一定相等 | |
| D. | 为了提高H2的转化率,可适当提高N2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
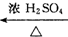 A(C4H8O3)$→_{△}^{浓H_{2}SO_{4}}$乙,甲、乙的分子式都为C4H6O2,甲能使溴的四氯化碳溶液褪色,乙为五元环状化合物,则甲不能发生的反应类型有( )
A(C4H8O3)$→_{△}^{浓H_{2}SO_{4}}$乙,甲、乙的分子式都为C4H6O2,甲能使溴的四氯化碳溶液褪色,乙为五元环状化合物,则甲不能发生的反应类型有( )| A. | 消去反应 | B. | 酯化反应 | C. | 加聚反应 | D. | 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R'OH}{→}$RCOOR′
;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R'OH}{→}$RCOOR′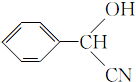 ;
; ;
;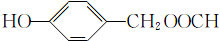 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
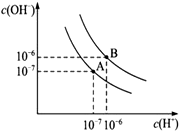 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
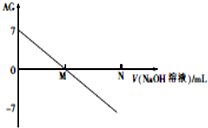 为了更好地表示溶液的酸碱性,科学家提出了酸度(aciditygrade)的概念,定义AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1 醋酸,滴定结果如图所示,下列有关叙述不正确的是( )
为了更好地表示溶液的酸碱性,科学家提出了酸度(aciditygrade)的概念,定义AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1 醋酸,滴定结果如图所示,下列有关叙述不正确的是( )| A. | 室温下,醋酸的电离平衡常数约为10-6 | |
| B. | M点加入NaOH溶液的体积大于20.00mL | |
| C. | M点时溶液中:c(CH3COO-)=c(Na+) | |
| D. | 若N点时加入NaOH溶液的体积为40mL,则N点时溶液中:c(Na+)=2[c(CH3COO-)+c(CH3COOH)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
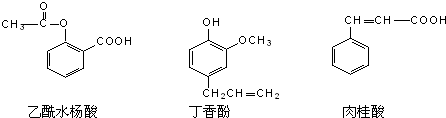
| A. | ①② | B. | ③④ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com