
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
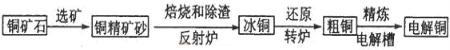
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
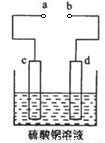
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
(1)Cu2S、FeS(每空1分);2FeS+3O2 2FeO+2SO2(缺少条件的扣1分)
2FeO+2SO2(缺少条件的扣1分)
(2)2/3mol(3分,没有单位或单位错误扣1分)
(3)正(1分),Fe-2e-=Fe2+;Cu-2e-=Cu2+(4分,每个方程式2分)
(4)酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化),所以不能用碱式滴定管盛酸性高锰酸钾溶液(必须答出两个要点:一是氧化性;二是橡皮管。缺少一个要点不得分)。
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;偏低。
【解析】
试题分析:(1)Cu的低价为+1价,Fe的低价为+2价,所以两种低价硫化物的化学式分别为Cu2S、FeS;Fe的硫化物转化为低价氧化物,FeS与O2反应生成FeO和SO2,配平可得化学方程式:2FeS+3O2 2FeO+2SO2。
2FeO+2SO2。
(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2 2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。
2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。
(3)c为粗铜板,为阳极,则a端应连接电源的正极;Fe的活泼性大于Cu,所以阳极即c电极Fe和Cu失电子,发生反应的方程式为:Fe-2e-=Fe2+;Cu-2e-=Cu2+。
(4)碱式滴定管含有橡皮管,易被强氧化剂氧化而老化,酸性高锰酸钾具有强氧化性,所以不能用碱式滴定管盛酸性高锰酸钾溶液;MnO4?在酸性条件下把Fe2+氧化为Fe3+,MnO4?被还原为Mn2+,根据化合价升降法配平可得离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;滴定时,锥形瓶中的溶液会接触空气,空气中的O2能氧化Fe2+,所以酸性高锰酸钾溶液用量减少,测得铁元素的含量会偏低。
考点:本题考查化学方程式、离子方程式的书写、氧化还原反应原理、电解原理、误差分析。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:2013届天津市天津一中高三第二次月考化学试卷(带解析) 题型:填空题
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: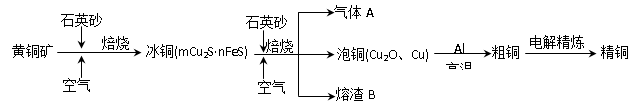
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,检验溶液中是否含有Fe3+的方法是_____________________________(注明试剂、现象)。若检验溶液中还存在Fe2+的方法是__________(注明试剂、现象),写出反应的离子方程式:____________________________
己知:Ksp [Fe(OH)3]= 4.0×10-38, 若所得溶液中只含Fe3+,在溶液中加入一定量的石灰水,调节溶液的pH为5,此时Fe3+的浓度
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.CuSO4溶液的浓度不变 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
精炼后电解质溶液中的阳离子有:_____________________________________
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
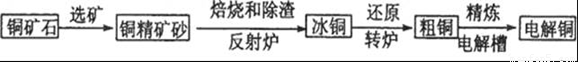
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是__________、__________,反射炉内生成炉渣的主要成分是__________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98. 5%的粗铜,该过程发生反应的化学方程式分别是__________、__________。
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);在电极d上发生的电极反应式为____________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。
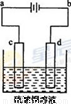
查看答案和解析>>
科目:高中化学 来源:2014届河南省许昌平顶山新乡三市高三第一次调研理综化学试卷(解析版) 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是__________、__________,反射炉内生成炉渣的主要成分是__________;
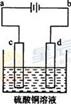 (2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是__________、__________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是__________、__________。
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);在电极d上发生的电极反应式为____________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com