
| A. | 苯酚溶液显弱酸性 | |
| B. | 苯酚和乙醇中,分别加入金属钠,苯酚反应剧烈 | |
| C. | 苯酚比苯容易发生溴代反应 | |
| D. | 苯酚能与氢氧化钠溶液反应,而苯甲醇不能 |
分析 -OH和苯环是相互活化的,-OH使苯环活化表现为苯酚中的苯环更易被取代;苯环使-OH活化表现为酚羟基显酸性,和钠的反应更剧烈,能和氢氧化钠反应,据此分析.
解答 解:A、苯酚溶液显弱酸性,说明苯环使-OH活化,比醇羟基更易电离,故A错误;
B、分别加入金属钠,苯酚中明显反应剧烈,说明酚羟基比醇羟基更活泼,体现了苯环对-OH的影响,故B错误.
C、苯酚比苯容易发生溴代反应,说明苯酚中的苯环比苯更活泼,体现了-OH对苯环的影响,故C正确;
D、苯酚能与氢氧化钠反应,说明酚羟基显酸性,而苯甲醇不能,说明只有当-OH直接连在苯环上时,苯环会使-OH活化,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重原子团相互影响的考查,注意羟基对苯环影响,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A. | NH4+:气体法 | B. | Cl-:沉淀法 | C. | I2:显色法 | D. | SO42-:气体法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②① | B. | ①②③④ | C. | ③②④① | D. | ③④②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HN03溶液混有H2SO4,可加入适量的BaCl2溶液,过滤除去 | |
| B. | 向某溶液中加入稀H2SO4,有无色无味气体生成,说明原溶液中一定含有CO32- | |
| C. | 乙酸乙酯(沸点77℃)中混有乙醇,可以用蒸馏法提纯 | |
| D. | 饱和食盐水可以除去Cl2中的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子排布图: | |
| B. | HF的电子式: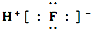 | |
| C. | Fe2+的核外电子排布式:1s22s22p63s23p63d6 | |
| D. | N2的结构简式::N≡N: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com