
| A. | 烧碱可做食品干燥剂 | B. | 经常接触铅笔芯易造成铅中毒 | ||
| C. | 盐类都可以用作调味品 | D. | 蚕丝的主要成分是蛋白质 |
科目:高中化学 来源: 题型:解答题
 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mL 12 mol/L的盐酸 | B. | 10 mL 18 mol/L的硫酸 | ||
| C. | 80 mL 2 mol/L的硫酸 | D. | 40 mL 14 mol/L的硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最易失去的电子能量最高 | |
| B. | L层电子比K层电子能量高 | |
| C. | p轨道电子能量一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
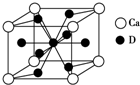 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
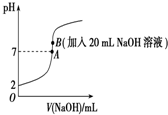 25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:
25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com