
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ②③④ |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.2mol | C. | 2mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
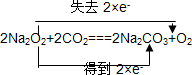 、
、 、2aOH+CO2=Na2CO3+H2O.
、2aOH+CO2=Na2CO3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ①④⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{5a}{b}$ mol/L | B. | $\frac{10a}{b}$ mol/L | C. | $\frac{b}{5a}$ mol/L | D. | $\frac{a}{b}$ mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、MnO4-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | K+、Na+、AlO2-、NO3- | D. | Mg2+、K+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应正好达平衡 | |
| B. | 反应向左进行 | |
| C. | 反应向某方向进行一段时间后K<57.0 | |
| D. | 反应向某方向进行一段时间后c(H2)<0.2 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com