
写出除去下列气体中混有的杂质(括号内为杂质)可采取的方法:
(1)CO(CO2):________________________________________________________________。
(2)CO2(CO):_________________________________________________________________。
(3)CO2(O2):__________________________________________________________________。
(4)CO2(SO2):_________________________________________________________________。
(5)CO2(HCl):__________________________________________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.-488.3 kJ·mol-1 B.488.3 kJ·mol-1
C.-191 kJ·mol-1 D.191 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,发生反应:①M(s)+N(g)R(g) ΔH=-Q1 kJ·mol-1,
②2R(g)+N(g)2T(g) ΔH=-Q2 kJ·mol-1。Q1、Q2、Q3均为正值。下列说法正确的是( )
A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N (g)的能量总和
B.将2 mol R(g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ
C.当1 mol M(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+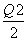 ) kJ
) kJ
D.M(g)+N(g)R(g) ΔH=-Q3 kJ·mol-1,则Q3<Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1②X(g)—→C(g) ΔH2,反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是( )
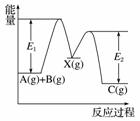
A.ΔH1=ΔH-ΔH2>0
B.X是反应A(g)+B(g)—→C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1 NaOH溶液中,充分反应后溶液中c(CO )与c(HCO
)与c(HCO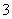 )的比值为(不考虑CO
)的比值为(不考虑CO 、HCO
、HCO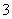 的水解)( )
的水解)( )
A.1∶1 B.1∶2 C.2∶1 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是________。
(2)工业上生产粗硅的反应有:SiO2+2C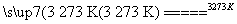 Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C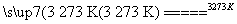 SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1∶1,则参加反应的C和SiO2的物质的量之比为________。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1∶1,则参加反应的C和SiO2的物质的量之比为________。
(3)工业上可以通过如图所示的流程制取纯硅:
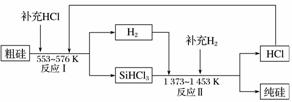
①若反应Ⅰ为Si(粗)+3HCl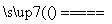 SiHCl3+H2,则反应Ⅱ的化学方程式为________________________。
SiHCl3+H2,则反应Ⅱ的化学方程式为________________________。
②整个制备过程中必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:__________________。
③假设每一轮次制备1 mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等。以下是工业上制取纯硅的一种方法。
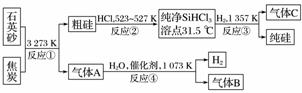
请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有________(填反应代号)。
(2)写出反应③的化学方程式_________________________________________。
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____________________________________。
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是__________(填化学式);分别通入W溶液中能得到白色沉淀的气体是______________(填化学式)。
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1.判断正误,正确的划“√”,错误的划“×”
(1)因漂白粉在空气中不稳定,故可用于漂白纸张( )
(2014·江苏,4C)
(2)将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色,证明Br2的氧化性强于I2( )
(2014·四川理综,4C)
(3)制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体( )
(2014·天津理综,2B)
(4)碘是人体必需微量元素,所以要多吃富含高碘酸的食物( )
(2013·新课标全国卷I,7C)
(5)次氯酸钠溶液可用于环境的消毒杀菌( )
(2013·四川理综,1D)
(6)实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取( )
(2013·浙江理综,8A)
(7)从海水中提取物质都必须通过化学反应才能实现( )
(2013·福建理综,6B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com