
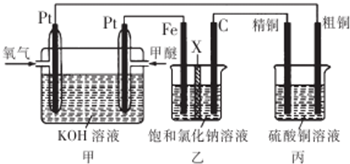
| A. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -═Fe2+ | |
| C. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
分析 燃料电池中,通入燃料的电极是负极,通入氧化剂的电极是正极,则Fe为阴极,C为阳极,精铜为阴极,粗铜为阳极;
A.正极上氧气得电子生成氢氧根离子;
B.阴极上溶液中的阳离子得电子;
C.乙中阴极上氢离子放电生成氢气和氢氧根离子;
D.阳极上活泼性比铜强的金属先失电子,阴极上只有铜离子得电子.
解答 解:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,则Fe为阴极,C为阳极,精铜为阴极,粗铜为阳极;
A.正极上氧气得电子生成氢氧根离子,所以正极发生的电极反应为O2+4e -+2H2O=4OH-,故A错误;
B.乙装置中铁电极为阴极,阴极上溶液中的阳离子得电子,则阴极电极方程式为2H++2e-═H2↑,故B错误;
C.乙中Fe为阴极,阴极上氢离子放电生成氢气和氢氧根离子,所以乙装置中生成的氢氧化钠在铁极区,故C正确;
D.阳极上活泼性比铜强的金属先失电子,阴极上只有铜离子得电子,由于两极上得失电子守恒,所以溶解的Cu与生成的Cu不相同,则溶液中铜离子浓度减小,故D错误.
故选C.
点评 本题综合考查电解池和原电池知识,注意把握电化学工作原理,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{2mol}$ | B. | $\frac{a}{22.4-b}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | $\frac{b}{2}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | Na+、Mg2+、X |
| 阴离子 | Cl-、SO32-、Y、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷的密度比水大,且难溶于水 | B. | 己烷在光照时能发生取代反应 | ||
| C. | 己烷在光照时能发生加成反应 | D. | 己烷不易燃烧,可作为灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能转化为电能的装置 | |
| B. | 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 把锌片放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com