
【题目】Ⅰ.已知:H2A的A2-可表示S2-、SO42-、SO32-、SiO32-或CO32-。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
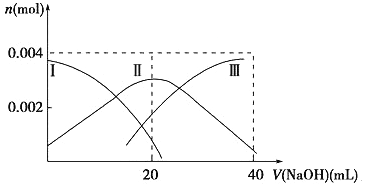
当V(NaOH)=20 mL时,溶液中离子浓度大小关系:____________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水____________(填“大”、“小”或“相等”)。
(2)若H2A为硫酸:t℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=____________。
Ⅱ.已知:在25 ℃时 H2O![]() H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH![]() H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh具体数值=________________,
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a,1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为___________, a与b的关系为______________。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数为____________。
【答案】(1)①c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) ②小
(2)10-13 (3)Kh=5.6×10-10
(4)小于、大于(5) b·10-7/(a-b)
【解析】
试题分析:Ⅰ.(1)①当V(NaOH)=20 mL时,二者恰好反应生成NaHA,根据图像可知A2-浓度大于H2A浓度,这说明HA-的电离程度大于水解程度,溶液显酸性,则溶液中离子浓度大小关系为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
②等体积等浓度的NaOH溶液与H2A溶液混合后生成NaHA,HA-的电离程度大于水解程度,溶液显酸性,所以其溶液中水的电离程度比纯水小。
(2)若H2A为硫酸:t℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则氢氧化钠溶液中氢氧根的浓度是0.01mol/L,所以该温度下水的离子积常数KW=10-11×0.01=10-13。
Ⅱ(3)醋酸钠水解的平衡常数Kh=![]() =5.6×10-10;
=5.6×10-10;
(4)稀释促进水解,即醋酸根浓度越小水解程度越大,则a>b;醋酸钠的浓度越小,碱性越弱,pH越小,则m<n;
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则根据电荷守恒可知溶液中c(NH4+)=c(Cl-)=0.5bmol/L,溶液中一水合氨的浓度为0.5(a-b)mol/L,则用a、b表示NH3·H2O的电离平衡常数为![]() =b·10-7/(a-b)。
=b·10-7/(a-b)。


科目:高中化学 来源: 题型:
【题目】下列选项中,符合右图所示关系的是( )

A. 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系
B. 在光照情况下,一定体积的饱和氯水的pH(Y)随时间(X)的关系
C. 100℃,1个大气压下,按体积比1∶1混合的CO2和H2O(g)混合气通过足量Na2O2粉末,固体增加的质量(Y)与混合气体积(X)的关系
D. 向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3 的物质的量(Y)与消耗NaOH的物质的量(X)的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示的装置在实验室中用途比较广泛:

①排空气法收集气体,若收集CO2气体,进气口为_______ (填“a”或“b”)。
②若瓶中装满水,可用于收集下列气体中的_________(选填编号)。
A、NO B、NO2 C、NH3 D、HCl
此时进气口为____________(填“a”或“b”)。
③如果广口瓶中盛放浓硫酸,可用作气体干燥装置,则该装置不可以干燥的气体有____________(选填编号)。
A、HCl B、NH3 C、H2 D、CO
④此装置还可用于除去气体中的杂质气体。若要用此装置除去CO2中混有的少量SO2气体,则装置中应盛放的液体可能是____________(选填编号)。
A、NaOH溶液 B、饱和Na2CO3溶液 C、饱和NaHCO3溶液 D、浓H2SO4
(2)下面是中学化学实验中常见的几种仪器:
A.量筒 B.容量瓶 C.试管 D.圆底烧瓶 E.托盘天平
①其中仪器上要标出使用温度的是_____________(填选项)
②可用作反应容器并能进行加热的是___________(填选项)
③下列操作,使得实验结果偏小的是____________(填选项)
A.称取5.2 gNaCl固体时,将砝码放在左盘,NaCl固体放在右盘
B.配制一定物质的量浓度的NaCl溶液,转移NaCl溶液前,容量瓶中已有少许蒸馏水
C. 配制一定物质的量浓度的NaCl溶液,定容时俯视读数。
D.用量筒量取一定体积的浓硫酸,浓硫酸倒入烧杯后,用蒸馏水继续冲洗量筒内壁并将洗涤液倒入烧杯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将小块生石灰投入盛有水的试管中,发生剧烈反应。一段时间后,用手触摸试管外壁感觉烫手,这个实验事实说明该反应
A. 是放热反应 B. 是吸热反应
C. 反应过程中热能转化为化学能 D. 反应物的总能量等于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4,4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-)是一种新型的自来水处理剂,它的性质和作用是( )
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A—I均为芳香族化合物,A的分子式为C8H10O, E的分子式为C7H7Cl,I的分子式为C23H22O3
②A的苯环上只有一个取代基,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰
③![]()
④![]()
芳香酯I的合成路线如下:

请回答下列问题:
(1)A→B的反应类型为 ,E的名称为 ;
(2)E→F与F→G的顺序不能颠倒,理由是 ;
(3)B与银氨溶液反应的化学方程式为 ;
(4)I的结构简式为 ;
(5)符合下列要求A的同分异构体还有 种(不包括A);
①与Na反应并产生H2 ②芳香族化合物
(6)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生成在一起,故有“生命金属”之称。下列有关4822Ti和5022Ti的说法正确的是
A. 质量数相同,互为同位素
B. 质子数相同,互为同位素
C. 中子数相同,属同一种元素的不同核素
D. 核外电子数相同,中子数不同,不能互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质,可利用明矾石制备氢氧化铝。
(1)已知明矾石脱水后要硫化,化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂与还原剂的物质的量之比是___________;若生成1 mol Al2O3,则转移的电子数为________。
2Al2O3+9SO2,该反应的氧化剂与还原剂的物质的量之比是___________;若生成1 mol Al2O3,则转移的电子数为________。
(2)证明废渣中含有Fe2O3 的化学方法:_____________________。
II.镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为:Mg17Al12 + 17H2=17MgH2 + 12Al ,得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
(3)熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_____________________
(4)在6.0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为_______mol。(已知:MgH2 + 2HCl = MgCl2 + 2H2↑)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 第三周期所含的元素中钠的第一电离能最小
B. 铝的第一电离能比镁的第一电离能大
C. 在所有元素中,氟的第一电离能最大
D. 钾的第一电离能比镁的第一电离能大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com