
 草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.
草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.分析 (1)草酸钠(Na2C2O4)溶液显碱性是草酸根离子水解导致;
(2)根据KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,并利用质量守恒定律、电荷守恒来书写离子反应方程式;
(3)相同温度下,酸的浓度越小其电离程度越大,草酸和碱反应消耗碱的物质的量与酸的物质的量成正比;
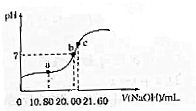
(4)①用0.100mol/L NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,根据c点离子浓度之间的关系,得到c点的溶液是草酸钠的水溶液,根据滴定原理来计算;
②a点所示溶液显示酸性,此时草酸剩余,得到的是草酸和草酸钠的混合物,据此回答;
(5)①根据Ksp的意义结合物质的量浓度公式c=$\frac{n}{V}$来计算;
②根据Ksp表达式得到溶液中c(Fe2-):c(Ca2-)等于Ksp(FeC2O4):Ksp(CaC2O4),据此计算.
解答 解:(1)草酸钠(Na2C2O4)溶液显碱性是草酸根离子水解导致,水解方程式为:C2O42-+H2O?HC2O4-+OH-,HC2O4-+H2O?H2C2O4+OH-,故答案为:C2O42-+H2O?HC2O4-+OH-,HC2O4-+H2O?H2C2O4+OH-;
(2)由KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,则反应为2KMnO4+5Na2C2O4+8H2SO4 =K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,离子方程式是:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O;
(3)相同温度下,酸的浓度越小其电离程度越大,所以pH=3草酸的浓度大于pH=4草酸浓度的10倍,10mLpH=3的草酸溶液和100mLpH=4的草酸溶液,前者的物质的量大于后者,草酸和碱反应消耗碱的物质的量与酸的物质的量成正比,所以消耗氢氧化钠体积V1>V2;故答案为:>;
(4)①用0.100mol/L NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,根据c点离子浓度之间的关系,得到c点的溶液是草酸钠的水溶液,草酸和氢氧化钠之间按照1:2物质的量之比进行反应,所以该草酸溶液的物质的量浓度为$\frac{0.100mol/L×21.6mL}{20.00mL}$≈0.11mol/L,故答案为:0.11mol/L;
②a点所示溶液显示酸性,此时草酸剩余,得到的是草酸和草酸钠的混合物,各离子的浓度由大到小的顺序为c(C2O42-)>c(Na+)>c(H+)>c(HC2O4-)>c(OH-),故答案为:c(C2O42-)>c(Na+)>c(H+)>c(HC2O4-)>c(OH-);
(5)①已知Ksp(CaC2O4)=2.5×10-9,假设溶液的体积是1L,所以溶解的草酸钙的物质的量是5×10-5mol,物质的量浓度c=$\frac{n}{V}$=5×10-5mol/L,故答案为:5×10-5mol/L;
②此温度下,向Na2C2O4溶液中加入FeCl2与CaCl2,当两种沉淀共存时,溶液中c(Fe2-):c(Ca2-)=Ksp(FeC2O4):Ksp(CaC2O4)=$\frac{2.0×1{0}^{-7}}{2.5×1{0}^{-9}}$=80,故答案为:80.
点评 本题考查学生盐的水解原理的应用以及沉淀溶解平衡的有关计算知识,注意知识的迁移应用是解题的关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y>M | B. | X>M>Z>Y | C. | M>Y>Z>X | D. | M>X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{ρ•w}{M}$ | B. | c=$\frac{ρ•M}{w}$ | C. | c=$\frac{M}{m•V}$ | D. | c=$\frac{m}{M•V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3具有还原性 | B. | 液氨、氨气、氨水是同一种物质 | ||
| C. | 氨气是非电解质,氨水是电解质 | D. | 氨水的主要成分是NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 0.5 mol/L MgCl2溶液 | B. | 100mL 1.0mol/L HCl溶液 | ||
| C. | 250mL 1.5mol/L NaCl溶液 | D. | 300 mL 0.25mol/L CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA | |
| B. | 常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA | |
| C. | 室温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com