
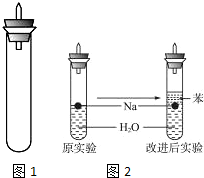
 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图:分析 (1)Al和NaOH溶液反应生成偏铝酸钠和氢气;
(2)可燃性气体与空气混合可能发生爆炸;
(3)大块的钠与水反应剧烈,放出大量的热,氢气和氧气混合点燃会发生爆炸;
(4)钠的密度比煤油大,比水小;
(5)钠与水发生反应2Na+2H2O=2NaOH+H2↑,根据n=$\frac{m}{M}$计算金属Na的物质的量,由方程式计算n(NaOH),生成氢气的体积,再根据c=$\frac{n}{V}$计算形成的氢氧化钠溶液的浓度.
解答 解:(1)Al和NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑,反应的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(2)可燃性气体与空气混合可能发生爆炸,点燃前需要先验纯,故答案为:验纯;
(3)大块的钠与水反应剧烈,放出大量的热,可能使试管内H2和O2的混合气点燃而爆炸,
故答案为:大块的钠与水反应剧烈,放出大量的热,可能使试管内H2和O2的混合气点燃而爆炸;
(4)钠处于苯和水的交界处,钠与水反应产生的H2使钠浮起,脱离水面,反应停止;
当钠表面的H2逸出,钠又回落水层,如此反复,减小了Na与H2O的反应速率,
故答案为:减慢;
(5)2.3g金属钠的物质的量为$\frac{2.3g}{23g/mol}$=0.1mol,
令生成的氢氧化钠的物质的量为y,生成氢气物质的量为z,则:
2Na+2H2O=2NaOH+H2↑
2 2 1
0.1mol y z
所以2:2=0.1mol:y,解得y=0.1mol
2:1=0.1:z,z=0.05mol
生成氢气标准状况下体积=0.05mol×22.4L/mol=1.12L,
故所得氢氧化钠溶液的物质的量浓度为$\frac{0.1mol}{0.02L}$=5mol/L,
故答案为:1.12L;5mol/L.
点评 本题考查常见气体制备原理及装置选择,及物质的量浓度计算,题目难度不大,注意钠与水反应时,取用的钠块不能太大.注意(3)要考虑题给密度的关系,确定钠在反应体系中的位置关系.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:多选题
| A. | 1 mol FeBr2与足量氯气反应时,理论上转移的电子数约为3×6.02×1023 | |
| B. | 常温下,pH均为3的三种溶液:①HCl溶液 ②H2SO4溶液③CH3COOH溶液,各自溶质的物质的量浓度大小顺序为①=②<③ | |
| C. | 电解熔融NaCl或AlCl3制取Na或Al | |
| D. | 一定条件下反应Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)达到平衡后,滴加少量浓硫酸,重新达平衡前,2v正(Cr2O72-)<v逆(CrO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
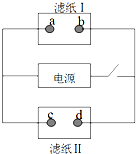 如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )
如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )| A. | a点和电源正极相连 | B. | b点发生还原反应 | ||
| C. | c点附近pH减小 | D. | d点附近颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
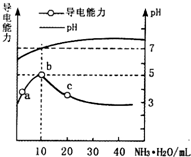 常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | |
| B. | b点溶液pH=5,此时酸碱恰好中和 | |
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯能使溴水褪色,是因为苯与溴发生了化学反应 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2二甲基丙烷与Br2反应,其一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com