
已知酸性条件下有如下反应:2Cu+===Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物做了验证,实验操作和实验现象记录如下:
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和 蓝色溶液 | 无色气体和 蓝色溶液 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是 ( )
A.Cu B.Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
科目:高中化学 来源: 题型:
(1)原子序数小于36的X、 Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素, Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为_________,1molY2X2含有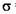 键的数目为____ __________________.
键的数目为____ __________________.
②化合物ZX3的沸点比化台物YX4的高,其主要原因是_____________。
 ③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
(2)铁元素能形成多种配合物,如:Fe(CO)x
①基态Fe3+的M层电子排布式为___________________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为
18.则x=_________。常温下呈液态,熔点为-20.5℃,沸
点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(填晶体类型):
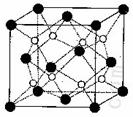
(3)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_________。已知该晶胞的密度为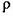 g/cm
g/cm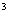 ,阿伏加德罗常数为
,阿伏加德罗常数为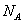 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含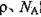 的计算式表示)
的计算式表示)
(4)下列有关的说法正确的是_____________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为品格能Ca0比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C都是金属,把A浸入C的盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C金属的活动性顺序为 ( )
A.B>A>C B.A>C>B C.A>B>C D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的工业制法中正确的是 ( )
A.制钛:用金属钠置换四氯化钛(TiCl4)溶液中的钛
B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
金属材料在日常生活以及生产中有着广泛的应用。下列关于金属的一些说法不正确的是
( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Cu都是用热还原法制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙为单质,丙、丁为化合物,它们之间存在如图所示的转化关系。
(1)若甲、乙均为非金属,丙为氧化物,则:
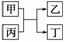 ①乙为氧化产物时,乙可能是________(填化学式,下同),按照元素周期表推测,此时反应物甲可能是__________________________________。
①乙为氧化产物时,乙可能是________(填化学式,下同),按照元素周期表推测,此时反应物甲可能是__________________________________。
②乙为还原产物时,丁所属的物质类别是___________________________________。
(2)若该转化关系为我国古代湿法冶炼金属乙的原理,写出此反应的化学方程式:__________________________________。若该转化关系为高温火法冶炼金属乙的原理,且同时生成的丁是一种有刺激性气味的气体,则丙可能为________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+。已知:AgSCN(白色,s)Ag++SCN-,Ksp=1.0×10-12,Fe3++SCN-(FeSCN)2+(红色),K=138,下列说法不正确的是( )
A.边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B.当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C.上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D.滴定时,必须控制溶液一定的酸性,防止Fe3+水解,以免影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25 ℃)
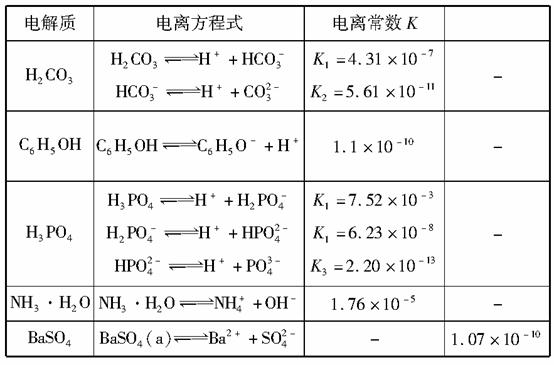
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:__________。
(2)25 ℃时,向10 mL 0.01 mol·L-1 C6H5OH溶液中滴加V mL 0.01 mol·L-1氨水,混合溶液中粒子浓度关系正确的是________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH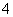 )=c(C6H5O-)+c(C6H5OH)
)=c(C6H5O-)+c(C6H5OH)
c.V=10时,混合液中水的电离程度小于0.01 mol·L-1 C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH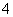 )>c(C6H5O-)>c(H+)>c(OH-)
)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义。25 ℃时,Na2CO3第一步水解反应的水解常数Kh=________mol·L-1。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
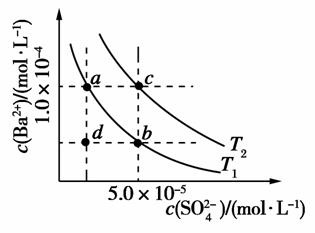
①T2________25℃(填“>”、“<”或“=”)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是________(填序号)。
a.加入Na2SO4不能使溶液a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的Fe 、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体(唯一还原产物)的体积与所得到剩余固体质量记录如下表(所有的气体的体积均在标准状况下测定)
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| HNO3溶液的体积(mL) | 100 | 200 | 300 | 400 | 500 |
| 剩余固体的质量(g) | 17.2 | 8 | 0 | 0 | 0 |
| 气体的体积(L) | 2.24 | 4.48 | 6.72 | 7.84 | 7.84 |
(1)该实验中所用的硝酸的物质的量浓度为 mol/L
(2)第1次实验反应的离子方程式 ,第2次实验后剩余固体的成份为
(填化学式)
(3)求实验中每次所取混合物中铜的质量 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com