
【题目】常温下向10mL 0.1molL﹣1CH3COONa溶液中,不断通入HCl后,CH3COO﹣与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( ) 
A.M点溶液中水的电离程度比原溶液小
B.在M点时,c(H+)﹣c(OH﹣)=(100a﹣5.0×10﹣2) mol/L
C.随着HCl的通入, ![]() 值不断减小
值不断减小
D.当n(HCl)=1.0×10﹣3mol时,溶液中c(Na+)>c(Cl﹣)>c(CHCOO﹣)>c(H+)>c(OH﹣)
【答案】D
【解析】解:A.CH3COO﹣水解促进水的电离,CH3COOH电离出氢离子抑制水的电离,原溶液为醋酸钠溶液,醋酸根离子水解促进水的电离,M点溶液显酸性,醋酸电离的氢离子抑制水的电离,所以M点溶液中水的电离程度比原溶液小,故A正确;
B.在M点时,溶液中存在电荷守恒为c(Na+)+c(H+)=c(Cl﹣)+c(CHCOO﹣)+c(OH﹣),则c(H+)﹣c(OH﹣)=c(Cl﹣)+c(CHCOO﹣)﹣c(Na+)=100a+0.05﹣0.1=(100a﹣5.0×10﹣2) mol/L,故B正确;
C.温度不变,水解常数Kh= ![]() 不变,随着HCl的加入,CH3COOH浓度逐渐增大,所以
不变,随着HCl的加入,CH3COOH浓度逐渐增大,所以 ![]() 逐渐减小,故C正确;
逐渐减小,故C正确;
D.当n(HCl)=1.0×10﹣3mol时,CH3COONa与HCl恰好反应生成等浓度的NaCl和CH3COOH,由于CH3COOH部分电离溶液显酸性,所以c(Na+)=c(Cl﹣)>c(CHCOO﹣)>c(H+)>c(OH﹣),故D错误.
故选D.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数约为6.02×1023mol﹣1 . 下列叙述中正确的是( )
A.标准状况下,4.48LCH3CH2OH中约含有1.204×1023个羟基
B.常温常压下,31g白磷P4和红磷P8的混合中约含有6.02×1023个磷原子
C.标准状况下,7.8g苯中约含有1.806×1023个碳碳双键
D.1molH2O2在MnO2催化作用下完全反应转移的电子数约为1.204×1024个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用盖斯定律可计算一些不易测定的反应的反应热.
(1)已知在298K时下述反应的有关数据:C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 则C(s)+CO2(g)=2CO(g) 的△H为 .
O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 则C(s)+CO2(g)=2CO(g) 的△H为 .
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJmol﹣l;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣l . 则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下: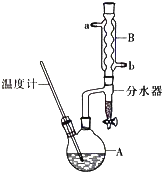
2CH3CH2CH2CH2OH ![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
相对分子质量 | 沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.分离提纯.
③待A中液体冷却后将其缓慢倒人盛有70mL水的分液谝斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 .
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去 , 振摇后静置,粗产物应从分液漏斗的(填“上”或“下”)口分离出.
(4)步骤③巾最后一次水洗的目的为 .
(5)步骤⑤中,加热蒸馏时应收集(填选项字母)左右的馏分.a.100℃b.117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为 , 下层液体的主要成分为 .
(7)本实验中,正丁醚的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.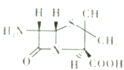
(1)N、P、S的第一电离能由小到大的顺序为 .
(2)组成蛋白质的最简单的氨基酸(HOOCCH2NH2)介子中,π键数目为 .
(3)Zn2+、Cu2+能与NH3、H2O、Cl﹣等形成配位数为4的配合物.①基态Zn2+的价电子(外围电子)排布式为 .
②[Zn(H2O)4]SO4中不存在的化学键类型有 . (填序号).
a.配位键 b.金属键 c.共价键 d.氢键 e.离子键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 .
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(4)由上述几种元素组成的6一氨基青霉烷酸的结构如图,其中采用sp3杂化的原子除了S外,还有 .
(5)紫外光的光子所具有的能量约为399kJmol﹣根据下表有关蛋白质分子中主要化学键的键能信息,说明人体长时间照射紫外光后皮肤易受伤害的原因是(填序号).
共价键 | C﹣C | C﹣N | C﹣S |
键能/(kJmol﹣1) | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在1L的密闭容器中充入NO2发生如下反应:2NO2(g)N2O4(g);△H=﹣57kJmol﹣1
(1)该反应的△S0(填“>”、“<”或“=”).
(2)当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01molL﹣1 , 则NO2的平衡转化率(α)是 . 25℃时上述反应的平衡常数K= .
(3)25℃时,实验测得该反应的活化能Ea=92.4kJmol﹣1 . 下列能量关系图合理的是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( ) 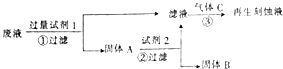
A.试剂1可以是铁也可以是铜
B.试剂2可以是盐酸也可以是硫酸
C.气体C为Cl2 , 不能用H2O2替换
D.步骤①②③中发生的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.所有卤代烃都难溶于水,且都是密度比水大的液体
B.卤代烃不属于烃类
C.所有卤代烃都是通过取代反应制得
D.卤代烃都是良好的有机溶剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com