
【题目】Ⅰ.纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:____________。
(2)实验室中用过氧化氢制取氧气的化学方程式为_______________,当生成标准状况下2.24L O2时,转移电子为______ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在其水溶液中的电离方程式:______。(只写第一步)
(4)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确:___________
Ⅱ.工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
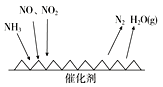
(1)由上图可知SCR技术中的氧化剂为________。
(2)用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________________________________
Ⅲ.研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应①:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
反应②:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2= +23.4 kJ/mol
2CH3OH(g) △H2= +23.4 kJ/mol
反应③:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
【答案】![]() 2H2O2
2H2O2![]() 2H2O+O2↑ 0.2 H2O2
2H2O+O2↑ 0.2 H2O2![]() H++HO2- 向褪色后的溶液中加入NaOH溶液,若变红,甲的说法正确;若不变红,乙的说法正确 NO、NO2 2NH3+NO+NO2
H++HO2- 向褪色后的溶液中加入NaOH溶液,若变红,甲的说法正确;若不变红,乙的说法正确 NO、NO2 2NH3+NO+NO2![]() 2N2+3H2O -122.6
2N2+3H2O -122.6
【解析】
(1)过氧化氢的电子式为: ![]() ;
;
(2)过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,方程式为: 2H2O2![]() 2H2O+O2↑ ;当生成2.24L O2时,即生成0.1mol氧气,转移0.2mol电子;
2H2O+O2↑ ;当生成2.24L O2时,即生成0.1mol氧气,转移0.2mol电子;
(3) H2O2为二元弱酸,其酸性比碳酸弱,所以电离方程式用可逆符号,电离方程式为H2O2![]() H++HO2-;
H++HO2-;
(4)向褪色后的溶液中加入氢氧化钠溶液,若变红,说明原溶液中没有氢氧根离子,甲的说法正确;若不变红,说明乙的说法正确;
Ⅱ.(1)从图分析,一氧化氮和二氧化氮中的氮元素化合价降低,做氧化剂;
(2) 用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1.,反应生成氮气和水,结合电子守恒和质量守恒得方程式为:2NH3+NO+NO2![]() 2N2+3H2O;
2N2+3H2O;
Ⅲ.根据盖斯定律分析,反应①:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.6kJ/mol;反应②:CH3OCH3(g)+H2O(g)
CH3OH(g)+H2O(g) △H1= -49.6kJ/mol;反应②:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2= +23.4kJ/mol;有①×2-②得反应③:2CO2(g)+6H2(g)
2CH3OH(g) △H2= +23.4kJ/mol;有①×2-②得反应③:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3= -49.6×2-23.4= -122.6kJ/mol。
CH3OCH3(g)+3H2O(g) △H3= -49.6×2-23.4= -122.6kJ/mol。


科目:高中化学 来源: 题型:
【题目】在强热条件下,硫酸亚铁固体可发生如下反应:2FeSO4![]() Fe2O3+SO2↑+SO3↑。若将此反应生成的气体先通入足量BaCl2溶液,再通入品红溶液中,则可能的现象为( )
Fe2O3+SO2↑+SO3↑。若将此反应生成的气体先通入足量BaCl2溶液,再通入品红溶液中,则可能的现象为( )
①BaCl2溶液中无沉淀析出;
②析出BaSO3沉淀;
③析出BaSO4沉淀;
④品红溶液褪色;
⑤品红溶液不褪色;
A.①④B.②④C.②③⑤D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2,X的核磁共振氢谱有4组峰且峰面积之比为1:2:2:3,X分子中只含一个苯环,且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图。下列关于X的说法中不正确的是( )
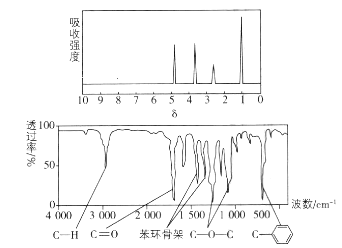
A.X分子属于酯类化合物,在一定条件下能发生水解反应
B.X在一定条件下可与3mol H2发生加成反应
C.符合题中X分子结构特征的有机物只有1种
D.与X属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为2mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法正确的是( )
A.该溶液中所含的离子是:Fe2+、Al3+、SO42-、NO3-
B.若向该溶液中加入过量的稀硫酸,产生的气体分子数为1/3NA
C.若向该溶液中加入过量的稀硫酸后若再滴加FeCl2溶液,没有现象
D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为160g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为中学化学常见的单质或化合物,其中A、F为单质,常温下,E的浓溶液能使铁、铝钝化,相互转化关系如图所示(条件已略去)。完成下列问题:

(1)若A为淡黄色固体,B为气体,F为非金属单质。
①写出E转变为C的化学方程式________________________________。
②B在空气中能使银器表面失去金属光泽、逐渐变黑,该反应的氧化剂和还原剂之比为_____。
(2)若B为能使湿润的红色石蕊试纸变蓝的气体。
①B和E反应得到的产物中所含的化学键类型为____________________。
②做过银镜反应后的试管可用E的稀溶液清洗,反应的离子方程式为___________________。
③在干燥状态下,向②反应得到的溶质中通入干燥的氯气,得到N2O5和一种气体单质,写出反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):

根据以上信息回答下列问题:
(1)B的结构简式是____________________。
(2)①的反应条件是________________;C→D的反应类型是_____________。
(3)下列对抗结肠炎药物有效成分可能具有的性质推测正确的是__________。
A.水溶性比苯酚好,密度比苯酚的大
B.能发生消去反应和聚合反应
C.能和氢氧化钠反应且1mol该分子可以中和3molNaOH
D.既有酸性又有碱性
(4)E与足量NaOH溶液反应的化学方程式是_____________________________________.
(5)符合下列条件的E的同分异构体有_______种,其中核磁共振氢谱有四组峰,峰面积之比1∶2∶2∶2∶1的异构体的结构简式为_________________。
a.与E具有相同的官能团 b.苯环上的一硝基取代产物有两种
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此设计以A为原料制备高分子化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此设计以A为原料制备高分子化合物 ![]() 的合成路线_________________________________。(无机试剂任选)
的合成路线_________________________________。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(Fe2O3)是一种常见颜料,用废铁屑制取铁红的工艺如图:

(1)写出废铁屑中的铁和稀硫酸反应的离子方程式:_____。
(2)“沉淀”反应中除生成FeCO3外,还生成一种能使澄清石灰水变浑浊的气体,该气体为_____。
(3)检验滤液中含有![]() 的方法是_____。
的方法是_____。
(4)“煅烧”时FeCO3与O2反应的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:Mg5Al3(OH)19(H2O)4![]() H2O↑+MgO+A12O3
H2O↑+MgO+A12O3
(1)请配平方程式_______________________。
(2)写出该化合物作阻燃剂的两条依据______。
(3)已知MgO可溶于NH4Cl的水溶液,其原理为______(用化学方程式和必要的文字说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com