
(11��)��֪ϡ������ͭ��Ӧʱ��NO3��һ�㱻��ԭΪNO��Ũ������ͭ��Ӧʱ��NO3��һ�㱻��ԭΪNO2���ֽ�25.6gCuͶ�뵽50mL12mol/L��Ũ�����У���ַ�Ӧ���ռ���4.48L�������NO��NO2�Ļ�����塣
��1������ԭ����������ʵ���Ϊ�� ��
��2��25.6gCu��50mL12mol/L�����ᷴӦ��ʣ����Ϊ�� ��
�����ʵ���Ϊ�� ��
��3���ݻ�Ϊ4.48L�ĸ�����ƿ����������Ӧ���ռ���NO��NO2�Ļ�����壨�����������ˮ�У�����ͨ�� L�������O2����ʹ��Һ������ƿ��
��4���������Ӧ�����ϵ���ټ���200mL4mol/L��ϡ���ᣬ�Ƿ��������ݳ�������,�������������ڱ���µ������Ҫ���м��̣����������λ��Ч���֣���
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
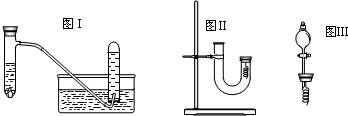
| ʵ�鲽�� | ���� |
| 1��U����˼���ϡ����ֱ������U���Ҷ� | ��/ |
| 2�ø���ͭ˿�Ľ�����סU���Ҷˣ��۲����� | ������ ����ɫ����������ұ���Һ�����ɫ ����ɫ����������ұ���Һ�����ɫ |
| 3����Ӧֹͣ��������۲�ʵ������ | ������ ��ɫ����������Ӵ���������ɺ���ɫ ��ɫ����������Ӵ���������ɺ���ɫ |
| 10-3a�qV +0.5 |
| 0.14 |
| 10-3a�qV +0.5 |
| 0.14 |
| 1 |
| 2 |
|
|
| 1 |
| 2 |
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��2011ѧ�����������������ѧ��һ��ѧ�����п��Ի�ѧ�Ծ� ���ͣ�������
(11��)��֪ϡ������ͭ��Ӧʱ��NO3��һ�㱻��ԭΪNO��Ũ������ͭ��Ӧʱ��NO3��һ�㱻��ԭΪNO2���ֽ�25.6gCuͶ�뵽50mL12mol/L��Ũ�����У���ַ�Ӧ���ռ���4.48L�������NO��NO2�Ļ�����塣
��1������ԭ����������ʵ���Ϊ�� ��
��2��25.6gCu��50mL12mol/L�����ᷴӦ��ʣ����Ϊ�� ��
�����ʵ���Ϊ�� ��
��3���ݻ�Ϊ4.48L�ĸ�����ƿ����������Ӧ���ռ���NO��NO2�Ļ�����壨�����������ˮ�У�����ͨ�� L�������O2����ʹ��Һ������ƿ��
��4���������Ӧ�����ϵ���ټ���200mL4mol/L��ϡ���ᣬ�Ƿ��������ݳ�������,�������������ڱ���µ������Ҫ���м��̣����������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����������������ѧ��һ��ѧ�����п��Ի�ѧ�Ծ� ���ͣ�������
(11��)��֪ϡ������ͭ��Ӧʱ��NO3��һ�㱻��ԭΪNO��Ũ������ͭ��Ӧʱ��NO3��һ�㱻��ԭΪNO2���ֽ�25.6gCuͶ�뵽50mL12mol/L��Ũ�����У���ַ�Ӧ���ռ���4.48L�������NO��NO2�Ļ�����塣
��1������ԭ����������ʵ���Ϊ�� ��
��2��25.6gCu��50mL12mol/L�����ᷴӦ��ʣ����Ϊ�� ��
�����ʵ���Ϊ�� ��
��3���ݻ�Ϊ4.48L�ĸ�����ƿ����������Ӧ���ռ���NO��NO2�Ļ�����壨�����������ˮ�У�����ͨ�� L�������O2����ʹ��Һ������ƿ��
��4���������Ӧ�����ϵ���ټ���200mL4mol/L��ϡ���ᣬ�Ƿ��������ݳ�������,�������������ڱ���µ������Ҫ���м��̣����������λ��Ч���֣���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com