

| A. | m+n<p+q△H>0 | B. | m+n>p+q△H>0 | C. | m+n<p+q△H<0 | D. | m+n>p+q△H<0 |
分析 根据图1可知,在a点之前是建立平衡的曲线,在a点之后是平衡受温度影响的曲线,可以看出,温度越高C的质量分数越小,说明平衡逆向移动,说明该反应的正反应是放热反应,在图2中,t时刻(温度不变)正逆反应速率都同时突然增大,所以改变影响平衡的条件应该是增大压强,而此时正反应速率大于逆反应速率,说明平衡正向移动,由此可确定该反应的正反应是气体体积减小的反应,据此答题.
解答 解:根据图1可知,在a点之前是建立平衡的曲线,在a点之后是平衡受温度影响的曲线,可以看出,温度越高C的质量分数越小,说明平衡逆向移动,说明该反应的正反应是放热反应,即△H<0,在图2中,t时刻(温度不变)正逆反应速率都同时突然增大,所以改变影响平衡的条件应该是增大压强,而此时正反应速率大于逆反应速率,说明平衡正向移动,由此可确定该反应的正反应是气体体积减小的反应,即m+n>p+q,
故选D.
点评 本题主要考查了影响平衡移动的因素,中等难度,解题的关键在于正确理解图象的意义,掌握基础是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | pH>7的溶液中:Na+、Mg2+、S042-、I- | |
| B. | 使甲基橙试液变红的溶液中:Al3+、Cu2+、N03-、SO42- | |
| C. | 由水电离出的c(H+)=l.0×10-13mol•L-1的溶液中:Na+、C032-、SO32-、Cl一 | |
| D. | 加铝粉能产生大量H2的溶液中:Na+、NH4+、N03-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的稀硫酸中含有的H+数为0.1NA | |
| B. | 1mol苯分子中含有的碳碳双键数为3NA | |
| C. | 18gH2O中含有的质子数为10NA | |
| D. | 50mL12mol•L-1的盐酸与足量的MnO2共热,生成的Cl2分子数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和溴水共热 | B. | 光照甲苯与氯气的混合物 | ||
| C. | 溴乙烷与NaOH溶液共热 | D. | 乙烷通入溴的四氯化碳溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 操作 | 从CCl4萃取溴水中溴后的混合液中分离 | 二氧化锰与浓盐酸反应制干燥氯气 | 可用于制备并观察氢氧化铁沉淀 | 检查装置气密性 |
| 实验装置 | 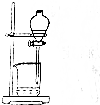 | 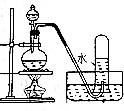 | 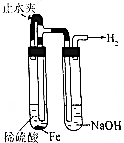 | 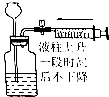 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 等质量的石墨比金刚石能量高 | |
| C. | 发生了物理变化 | |
| D. | 金刚石转化为石墨没有化学键的断裂与生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
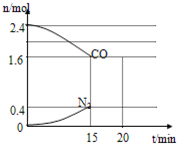 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
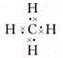 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com