
| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
分析 可逆反应反应物不能完全反应,达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
解答 解:A.该反应是可逆反应,N2不可能完全转化为NH3,故A错误;
B.达到平衡时,N2、H2、NH3的物质的量浓度不再发生变化而不是一定相等,反应平衡时各物质的浓度是否相等取决于起始时各物质的量的关系和转化的程度,N2、H2按1:3混合,化学计量数为1:3,所以转化率相等,平衡时,N2、H2的物质的量浓度一定为1:3,故B错误;
C.随反应进行,N2、H2和NH3的物质的量浓度发生变化,N2、H2和NH3的物质的量浓度不再变化,说明到达平衡状态,故C正确;
D.可逆反应时动态平衡,达到化学平衡时,正反应和逆反应的速率相同但不为零,故D错误;
故选C.
点评 本题考查平衡状态的判断,选择判断的标准应随反应进行变化,当该标准不再变化说明到达平衡状态,题目难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
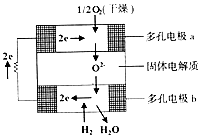 固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | O2-向电池的正极移动 | |
| B. | 有H2放电的b极为电池的正极 | |
| C. | a极对应的电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该电池的总反应方程式为2H2+O2=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰电池和碱性锌锰电池的正极材料均是锌 | |
| B. | 锌锰电池中电解质主要是NH4Cl,而碱性锌锰电池中的电解质主要是KOH | |
| C. | 碱性锌锰电池不如锌锰电池的寿命长 | |
| D. | 干电池放电之后还可再充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
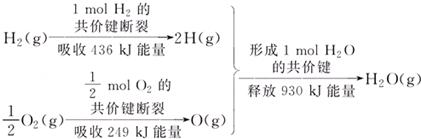
| A. | 1 mol H2的共价键形成放出436 kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2(g)跟0.5mol O2(g)反应生成1 mol H2O(g)释放能量245 KJ | |
| D. | 1 mol H2(g)与0.5mol O2(g)的总能量大于1 mol H2O(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
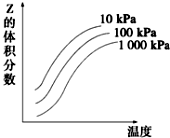 图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )
图是温度和压强对X+Y?2Z反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡时混合气体中Z的体积分数.下列叙述正确的是( )| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | 增大压强平衡向正反应方向移动 | D. | 上述反应的逆反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重氢原子:${\;}_{1}^{2}$D | |
| B. | S2-的结构示意图: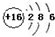 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | N2的电子式: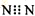 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 天然气、太阳能、生物质能、风能、氢能均属于新能源 | |
| C. | 自发反应的熵一定增大,非自发反应的熵一定减小 | |
| D. | 常温下,反应C(s)+CO2(g)?2CO(g)不能自发进行,则该反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com