
”¾ĢāÄæ”æĘū³µĪ²Ęų£ØÖ÷ŅŖ³É·ÖĪŖNOxŗĶCO£©ŅŃ³ÉĪŖÖ÷ŅŖµÄæÕĘųĪŪČ¾ĪļĄ“Ō“Ö®Ņ»£¬ÓŠ·¢Éś¹ā»ÆѧŃĢĪķĪŪČ¾µÄĒ±ŌŚĪ£ĻÕ”£
£Ø1£©Ä³Š”×éĶ¬Ń§ĪŖŃŠ¾æ¹ā»ÆѧŃĢĪķµÄŠĪ³É½ųŠŠĮĖÄ£ÄāŹµŃ锣²āµĆŃĢĪķµÄÖ÷ŅŖ³É·ÖĪŖCxHy(Ģž)”¢NO”¢NO2”¢O3”¢PAN £ØCH3COOONO2£©£¬ø÷ÖÖĪļÖŹµÄĻą¶ŌÅضČĖꏱ¼äµÄ±ä»ÆČēÓŅĶ¼”£øł¾ŻĶ¼ÖŠŹż¾Ż£¬ĻĀĮŠĶĘĀŪ×ī²»ŗĻĄķµÄŹĒ_____”££ØĢīŃ”ĻīŠņŗÅ×ÖÄø£©

a£®NOµÄĻūŹ§µÄĖŁĀŹ±ČCxHyæģ b£®NOÉś³ÉNO2
c£®CxHy¼°NO2æÉŅŌÉś³ÉPAN¼°O3 d£®O3Éś³ÉPAN
£Ø2£©Ņ»¶ØĢõ¼žĻĀ£¬½«2 mol NOÓė2 mol O2ÖĆÓŚŗćČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦2NO(g)£«O2(g) ![]() 2NO2(g)£¬ĻĀĮŠæÉÅŠ¶Ļ·“Ó¦“ļĘ½ŗāµÄŹĒ_____”££ØĢīŃ”ĻīŠņŗÅ×ÖÄø£©
2NO2(g)£¬ĻĀĮŠæÉÅŠ¶Ļ·“Ó¦“ļĘ½ŗāµÄŹĒ_____”££ØĢīŃ”ĻīŠņŗÅ×ÖÄø£©
a£®ĢåĻµŃ¹Ēæ±£³Ö²»±ä b£®»ģŗĻĘųĢåĆܶȱ£³Ö²»±ä
c£®NOŗĶO2µÄĪļÖŹµÄĮæÖ®±Č±£³Ö²»±ä d£®ĆæĻūŗÄ2 mol NOĶ¬Ź±Éś³É2 mol NO2
£Ø3£©øßĪĀĻĀN2ŗĶO2·¢ÉśN2(g)£«O2(g)![]() 2NO(g)·“Ó¦£¬ŹĒµ¼ÖĀĘū³µĪ²ĘųÖŠŗ¬ÓŠNOµÄŌŅņÖ®Ņ»”£
2NO(g)·“Ó¦£¬ŹĒµ¼ÖĀĘū³µĪ²ĘųÖŠŗ¬ÓŠNOµÄŌŅņÖ®Ņ»”£
¢ŁÓŅĶ¼ŹĒT1”¢T2Į½ÖÖ²»Ķ¬ĪĀ¶ČĻĀ£¬Ņ»¶ØĮæµÄNO·¢Éś·Ö½ā¹ż³ĢÖŠN2µÄĢå»ż·ÖŹżĖꏱ¼ä±ä»ÆµÄĶ¼Ļń£¬¾Ż“ĖÅŠ¶Ļ·“Ó¦N2(g)£«O2(g)![]() 2NO(g)ĪŖ_____£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦”£
2NO(g)ĪŖ_____£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦”£

¢Ś2000”ꏱ£¬ĻņČŻ»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė10 mol N2Óė5 mol O2£¬“ļµ½Ę½ŗāŗóNOµÄĪļÖŹµÄĮæĪŖ2 mol£¬Ōņ“ĖæĢ·“Ó¦µÄĘ½ŗā³£ŹżK£½_____”£øĆĪĀ¶ČĻĀ£¬ČōæŖŹ¼Ź±ĻņÉĻŹöČŻĘ÷ÖŠ³äČėN2ÓėO2¾łĪŖ1 mol£¬Ōņ“ļµ½Ę½ŗāŗóN2µÄ×Ŗ»ÆĀŹĪŖ_____”£

¢ŪĘū³µ¾»»Æ×°ÖĆĄļ×°ÓŠŗ¬Pd»ÆŗĻĪļµÄ“߻ƼĮ£¬ĘųĢåŌŚ“߻ƼĮ±ķĆęĪüø½Óė½āĪü×÷ÓƵĻśĄķČēÓŅĶ¼ĖłŹ¾”£Š“³öĘä±ä»ÆµÄ×Ü»Æѧ·“Ó¦·½³ĢŹ½£ŗ_____”£
£Ø4£©ĪŖ¼õÉŁĘū³µĪ²ĘųÖŠNOxµÄÅÅ·Å£¬³£²ÉÓĆCxHy£ØĢž£©“߻ƻ¹ŌNOxĻū³żµŖŃõ»ÆĪļµÄĪŪČ¾”£
ĄżČē£ŗCH4(g)£«4NO2(g)£½4NO(g)£«CO2(g)£«2H2O(g) ¦¤H1£½£574 kJ/mol
CH4(g)£«4NO(g)£½2N2(g)£«CO2(g)£«2H2O(g) ¦¤H2
Čō16 g CH4»¹ŌNO2ÖĮN2£¬¹²·Å³öČČĮæ867 kJ£¬Ōņ¦¤H2£½_____”£ČōÓƱź×¼×“æöĻĀ4.48 L CH4»¹ŌNO2ÖĮN2£¬¹²×ŖŅʵĵē×Ó×ÜŹżĪŖ_____£Ø°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµÓĆNA±ķŹ¾£©”£
”¾“š°ø”æ d ac ĪüČČ 1/9»ņ0.11 1/7»ņ14.3% 2NO£«O2£«4CO![]() 4CO2£«N2 £1160 kJ”¤mol-1 1.6 NA
4CO2£«N2 £1160 kJ”¤mol-1 1.6 NA
”¾½āĪö”æŹŌĢā·ÖĪö£ŗ±¾ĢāÖ÷ŅŖæ¼²éĶ¼ĻńµÄ·ÖĪö£¬»ÆŃ§Ę½ŗāµÄ±źÖ¾£¬»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬·“Ó¦ČČµÄ¼ĘĖć£¬Ńõ»Æ»¹Ō·“Ó¦ÖŠ×ŖŅʵē×ÓŹżµÄ¼ĘĖć”£
£Ø1£©a£¬øł¾ŻĶ¼Ź¾£¬ŌŚŅ»¶ĪŹ±¼äÄŚ£¬NOĻūŹ§µÄĖŁĀŹ±ČCxHyæģ£¬aĻīŗĻĄķ£»b£¬ÓÉĶ¼Ź¾£¬æŖŹ¼NO¼õÉŁµÄĶ¬Ź±NO2Ōö¶ą£¬NOÉś³ÉNO2£¬bĻīŗĻĄķ£»c£¬ÓÉĶ¼Ź¾£¬CxHy”¢NO2¼õÉŁµÄĶ¬Ź±PAN”¢O3Ōö¶ą£¬½įŗĻŌ×ÓŹŲŗć£¬CxHy¼°NO2æÉÉś³ÉPANŗĶO3£¬cĻīŗĻĄķ£»d£¬O3ÅØ¶ČŹ¼ÖÕŌö“ó£¬O3²»»įÉś³ÉPAN£¬dĻī²»ŗĻĄķ£»“š°øŃ”d”£
£Ø2£©a£¬øĆ·“Ó¦µÄÕż·“Ó¦ĪŖĘųĢå·Ö×ÓŹż¼õŠ”µÄ·“Ó¦£¬½ØĮ¢Ę½ŗā¹ż³ĢÖŠĘųĢå·Ö×ÓĪļÖŹµÄĮæ¼õŠ”£¬ŌŚŗćĪĀŗćČŻČŻĘ÷ÖŠ£¬ĢåĻµŃ¹Ēæ¼õŠ”£¬Ę½ŗāŹ±ĘųĢå·Ö×ÓĪļÖŹµÄĮæ²»±ä£¬ĢåĻµŃ¹Ēæ²»±ä£¬ĢåĻµŃ¹Ēæ²»±äÄÜÅŠ¶Ļ·“Ó¦“ļµ½Ę½ŗā£»b£¬øĆ·“Ó¦ÖŠĖłÓŠĪļÖŹ¶¼ŹĒĘųĢ壬øł¾ŻÖŹĮæŹŲŗć¶ØĀÉ£¬»ģŗĻĘųĢåµÄÖŹĮæŹ¼ÖÕ²»±ä£¬ČŻĘ÷µÄĢå»ż²»±ä£¬»ģŗĻĘųĢåµÄĆܶȏ¼ÖÕ²»±ä£¬»ģŗĻĘųĢåĆܶȱ£³Ö²»±ä²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£»c£¬ĘšŹ¼NOŗĶO2ĪļÖŹµÄĮæĻąµČ£¬½ØĮ¢Ę½ŗā¹ż³ĢÖŠ×Ŗ»ÆµÄNOŗĶO2ĪļÖŹµÄĮæÖ®±ČĪŖ2:1£¬½ØĮ¢Ę½ŗā¹ż³ĢÖŠNOŗĶO2ĪļÖŹµÄĮæÖ®±Č¼õŠ”£¬Ę½ŗāŹ±NOŗĶO2ĪļÖŹµÄĮæÖ®±Č²»ŌŁ±ä»Æ£¬NOŗĶO2ĪļÖŹµÄĮæÖ®±Č±£³Ö²»±äĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£»d£¬ĆæĻūŗÄ2molNOĶ¬Ź±Éś³É2molNO2Ö»±ķŹ¾Õż·“Ó¦£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāµÄŹĒac£¬“š°øŃ”ac”£
£Ø3£©¢ŁÓÉĶ¼ĻńæɼūT2ĻČ³öĻÖ¹Õµć£¬ĖµĆ÷T2·“Ó¦ĖŁĀŹæģ£¬ŌņT2![]() T1£»T2Ę½ŗāŹ±N2µÄĢå»ż·ÖŹżŠ”ÓŚT1Ź±£¬ĖµĆ÷ÉżøßĪĀ¶Č£¬·“Ó¦2NO£Øg£©
T1£»T2Ę½ŗāŹ±N2µÄĢå»ż·ÖŹżŠ”ÓŚT1Ź±£¬ĖµĆ÷ÉżøßĪĀ¶Č£¬·“Ó¦2NO£Øg£©![]() N2£Øg£©+O2£Øg£©ÄęĻņŅĘ¶Æ£¬·“Ó¦2NO£Øg£©
N2£Øg£©+O2£Øg£©ÄęĻņŅĘ¶Æ£¬·“Ó¦2NO£Øg£©![]() N2£Øg£©+O2£Øg£©µÄÄę·“Ó¦ĪŖĪüČČ·“Ó¦£¬¼“N2£Øg£©+O2£Øg£©
N2£Øg£©+O2£Øg£©µÄÄę·“Ó¦ĪŖĪüČČ·“Ó¦£¬¼“N2£Øg£©+O2£Øg£©![]() 2NO£Øg£©ĪŖĪüČČ·“Ó¦”£
2NO£Øg£©ĪŖĪüČČ·“Ó¦”£
¢ŚÓĆČż¶ĪŹ½
N2£Øg£©+O2£Øg£©![]() 2NO£Øg£©
2NO£Øg£©
n£ØĘšŹ¼£©£Ømol£© 10 5 0
n£Ø×Ŗ»Æ£©£Ømol£© 1 1 2
n£ØĘ½ŗā£©£Ømol£© 9 4 2
Ę½ŗāŹ±N2”¢O2”¢NOĪļÖŹµÄĮæÅضČŅĄ“ĪĪŖ4.5mol/L”¢2mol/L”¢1mol/L£¬·“Ó¦µÄĘ½ŗā³£ŹżK=![]() =
=![]() =
=![]() =0.11”£ČōæŖŹ¼ĻņČŻĘ÷ÖŠ³äČėN2ÓėO2¾łĪŖ1mol£¬Éč“ÓæŖŹ¼µ½Ę½ŗāŹ±×Ŗ»ÆN2ĪļÖŹµÄĮæĪŖx£¬ÓĆČż¶ĪŹ½
=0.11”£ČōæŖŹ¼ĻņČŻĘ÷ÖŠ³äČėN2ÓėO2¾łĪŖ1mol£¬Éč“ÓæŖŹ¼µ½Ę½ŗāŹ±×Ŗ»ÆN2ĪļÖŹµÄĮæĪŖx£¬ÓĆČż¶ĪŹ½
N2£Øg£©+O2£Øg£©![]() 2NO£Øg£©
2NO£Øg£©
n£ØĘšŹ¼£©£Ømol£© 1 1 0
n£Ø×Ŗ»Æ£©£Ømol£© x x 2x
n£ØĘ½ŗā£©£Ømol£© 1-x 1-x 2x
Ę½ŗāŹ±N2”¢O2”¢NOĪļÖŹµÄĮæÅضČŅĄ“ĪĪŖ£Ø1-x£©/2mol/L”¢£Ø1-x£©/2mol/L”¢xmol/L£¬K=![]() =
=![]() =
=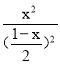 £¬½āµĆx=
£¬½āµĆx=![]() mol£¬“ļµ½Ę½ŗāŗóN2µÄ×Ŗ»ÆĀŹĪŖ
mol£¬“ļµ½Ę½ŗāŗóN2µÄ×Ŗ»ÆĀŹĪŖ![]() =
=![]() =0.143ӣ
=0.143ӣ
¢Ūøł¾ŻĶ¼Ź¾£¬·¢ÉśµÄ·“Ó¦ĪŖ2NO+O2=2NO2£Ø¢ŁŹ½£©£¬NO2ÓėCOŌŚ“߻ƼĮ×÷ÓĆĻĀÉś³ÉCO2ŗĶN2£¬·“Ó¦ĪŖ2NO2+4CO![]() N2+4CO2£Ø¢ŚŹ½£©£¬½«¢ŁŹ½+¢ŚŹ½£¬µĆ×Ü»Æѧ·“Ó¦·½³ĢŹ½ĪŖ£ŗ4CO+2NO+O2
N2+4CO2£Ø¢ŚŹ½£©£¬½«¢ŁŹ½+¢ŚŹ½£¬µĆ×Ü»Æѧ·“Ó¦·½³ĢŹ½ĪŖ£ŗ4CO+2NO+O2![]() N2+4CO2”£
N2+4CO2ӣ
£Ø4£©16gCH4»¹ŌNO2ÖĮN2¹²·Å³öČČĮæ867kJ£¬¼“1mol CH4»¹ŌNO2ÖĮN2¹²·Å³öČČĮæ867kJ£¬¾Ż“ĖæÉŠ“³öČČ»Æѧ·½³ĢŹ½£ŗCH4£Øg£©+2NO2£Øg£©=CO2£Øg£©+2H2O£Øg£©+N2£Øg£©¦¤H=-867kJ/mol£Ø¢ŁŹ½£©£¬CH4£Øg£©£«4NO2£Øg£©=4NO£Øg£©£«CO2£Øg£©£«2H2O£Øg£© ¦¤H1=-574 kJ/mol£Ø¢ŚŹ½£©£¬½«¢ŁŹ½![]() 2-¢ŚŹ½µĆCH4£Øg£©£«4NO£Øg£©=2N2£Øg£©£«CO2£Øg£©£«2H2O£Øg£© ¦¤H2=2¦¤H-¦¤H1=2
2-¢ŚŹ½µĆCH4£Øg£©£«4NO£Øg£©=2N2£Øg£©£«CO2£Øg£©£«2H2O£Øg£© ¦¤H2=2¦¤H-¦¤H1=2![]() £Ø-867kJ/mol£©-£Ø-574kJ/mol£©=-1160kJ/mol”£n£ØCH4£©=
£Ø-867kJ/mol£©-£Ø-574kJ/mol£©=-1160kJ/mol”£n£ØCH4£©=![]() =0.2mol£¬ŌŚ·“Ó¦ÖŠCH4±»Ńõ»Æ³ÉCO2£¬Ōņ·“Ó¦ÖŠ×ŖŅʵē×ÓĪļÖŹµÄĮæĪŖ0.2mol
=0.2mol£¬ŌŚ·“Ó¦ÖŠCH4±»Ńõ»Æ³ÉCO2£¬Ōņ·“Ó¦ÖŠ×ŖŅʵē×ÓĪļÖŹµÄĮæĪŖ0.2mol![]() 8=1.6mol£¬×ŖŅʵē×Ó×ÜŹżĪŖ1.6NA”£
8=1.6mol£¬×ŖŅʵē×Ó×ÜŹżĪŖ1.6NA”£


 µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø
µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĄė×ÓŌŚČÜŅŗÖŠÄÜ“óĮæ¹²“ęµÄŹĒ£Ø £©
A.Ca2+ Na+ NO3- Cl©B.Na+ K+ CO32- H+
C.Ba2+ Cu2+ SO42- OH©D.Cu2+ K+ CO32- Cl©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æīܼ°Ęä»ÆŗĻĪļŌŚÉś²śÖŠÓŠÖŲŅŖ×÷ÓĆ£¬»Ų“šĻĀĮŠĪŹĢā
(1)īÜŌŖĖŲ»łĢ¬Ō×ӵĵē×ÓÅŲ¼Ź½ĪŖ_________________£¬Ī“³É¶Ōµē×ÓŹżĪŖ________________”£
(2)ÅäŗĻĪļ[Co(NH3)4(H2O)2]Cl3ŹĒīÜÖŲŅŖ»ÆŗĻĪļ
¢ŁH2OµÄ·Šµć___ (Ģī”°øßÓŚ”±»ņ”°µĶÓŚ”±)H2S,ŌŅņŹĒ_______£»H2OÖŠOµÄŌӻƊĪŹ½ĪŖ_____”£H2OŹĒ_____·Ö×Ó(Ģī”°¼«ŠŌ”±»ņ”°·Ē¼«ŠŌ”±)”£
¢Ś[Co(NH3)4(H2O)2]Cl3Co3+ÅäĪ»ŹżĪŖ___”£ŃōĄė×ÓµÄĮ¢Ģå¹¹ŠĶŹĒ___________”£[Co(NH3)4(H2O)2]Cl3ČōĘäÖŠÓŠĮ½øöNH3·Ö×Ó±»ClČ”“ś£¬ĖłŠĪ³ÉµÄ[Co(NH3)2(H2O)2] 3+µÄ¼øŗĪŅģ¹¹ĢåÖÖŹżÓŠ(²»æ¼ĀĒ¹āѧŅģ¹¹)___________ÖÖ”£
(3)½šŹōīÜŹĒÓÉ______¼üŠĪ³ÉµÄ¾§Ģ壻CoO”¢FeOµÄ¾§Ģå½į¹¹ĄąŠĶ¾łÓėĀČ»ÆÄʵÄĻąĶ¬£¬Co2+ŗĶFe2+µÄĄė×Ó°ė¾¶·Ö±šĪŖ74.5pmŗĶ78pm,ŌņČŪµćCoO______FeO”£
(4)Ņ»Ńõ»Æīܵľ§°ūČēĶ¼£¬ŌņŌŚĆæøöCo2+µÄÖÜĪ§ÓėĖü×ī½Ó½üµÄĒŅ¾ąĄėĻąµČµÄCo2+¹²ÓŠ_____øö£¬Čō¾§ĢåÖŠCo2+ÓėO2-µÄ×īŠ”¾ąĄėĪŖacm£¬ŌņCoOµÄ¾§ĢåĆܶČĪŖ_______(ÓĆŗ¬NAŗĶaµÄ“śŹżŹ½±ķŹ¾”£½į¹ūg/cm3,ŅŃÖŖ:M(Co)=59g/mol£»M(O)=16g/mol£¬Éč°¢·š¼ÓµĀĀŽ³£ŹżĪŖNA)”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĶ¼Ź¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
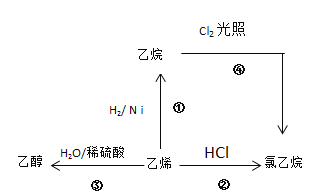
(1)°“ŅŖĒ󊓳öĻĀĮŠÓŠ»śĪļµÄ·Ö×Ó½į¹¹”£
ŅŅĻ©µÄµē×ÓŹ½__________£¬
ŅŅĶéµÄ·Ö×ÓŹ½________£¬
ŅŅ“¼µÄ½į¹¹Ź½___________£¬
ĀČŅŅĶéµÄ½į¹¹¼ņŹ½________”£
(2)Š“³ö¢Ś”¢¢ÜĮ½²½·“Ó¦µÄ»Æѧ·½³ĢŹ½£¬²¢×¢Ć÷·“Ó¦ĄąŠĶ
¢Ś_______________________£¬·“Ó¦ĄąŠĶ_______________”£
¢Ü_______________________£¬·“Ó¦ĄąŠĶ_______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ģŗĻČÜŅŗÖŠ£¬ø÷Ąė×ÓÅØ¶ČµÄ“óŠ”Ė³ŠņÕżČ·µÄŹĒ
A. 10L0.1mol”¤L-1°±Ė®Óė10L0.1mol”¤L-1ŃĪĖį»ģŗĻ£ŗ[Cl-]>[NH4+]>[OH-]>[H+]
B. 10mL0.1mol”¤L-1NH4ClČÜŅŗÓė5mL0.2mol”¤L-1NaOHČÜŅŗ»ģŗĻ£ŗ[Na+]=[Cl-]>[OH-]>[H+]
C. 10mL0.1mol”¤L-1CH3COOHČÜŅŗÓė5mL0.2mol”¤L-1NaOHČÜŅŗ»ģŗĻ£ŗ[Na+]=[CH3COO-]>[OH-]>[H+]
D. 10mL0.5mol”¤L-1CH3COONaČÜŅŗÓė6mL1mol”¤L-1ŃĪĖį»ģŗĻ£ŗ[Cl-]>[Na+]>[OH-]>[H+]
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潚Źō¼°Ęä»ÆŗĻĪļŌŚæĘѧъ¾æŗĶ¹¤ŅµÉś²śÖŠ¾ßÓŠÖŲŅŖµÄÓĆĶ¾”£
£Ø1£©ČżĀČ»ÆĢśČÜŅŗÓĆÓŚ¼ģŃéŹ³ÓĆĻć¾«ŅŅõ£ŅŅĖįŅŅõ„Ź±£¬»įÉś³É×ĻÉ«ÅäŗĻĪļ£¬ĘäÅäĄė×Ó½į¹¹ČēĶ¼ĖłŹ¾£ŗ
¢Ł“ĖÅäŗĻĪļÖŠ£¬ĢśĄė×Ó¼Ūµē×ÓÅŲ¼Ķ¼ĪŖ_____£»
¢Ś“ĖÅäĄė×ÓÖŠĢ¼Ō×ÓµÄŌӻƹģµĄĄąŠĶĪŖ_____£»
¢Ū“ĖÅäĄė×ÓÖŠŗ¬ÓŠµÄ»Æѧ¼üĪŖ_____”£
A£®Ąė×Ó¼ü B£®½šŹō¼ü C£®¼«ŠŌ¼ü D£®·Ē¼«ŠŌ¼ü E£®ÅäĪ»¼ü F£®Ēā¼ü G£®¦Ņ¼ü H£®¦Š¼ü
£Ø2£©NO2-ÓėīÜŃĪŠĪ³ÉµÄÅäĄė×Ó[Co(NO2)6]3-æÉÓĆÓŚ¼ģŃéK+µÄ“ęŌŚ”£NO2-Ąė×ÓµÄVSEPRÄ£ŠĶĆū³ĘĪŖ_____£¬K3[Co(NO2)6]ŹĒ»ĘÉ«³Įµķ£¬øĆĪļÖŹÖŠĖÄÖÖŌŖĖŲµÄµēøŗŠŌÓɓ󵽊”µÄĖ³ŠņŹĒ_____”£
£Ø3£©ŃŠ¾æĪļÖŹ“ÅŠŌ±ķĆ÷£ŗ½šŹōŃōĄė×Óŗ¬Ī“³É¶Ōµē×ÓŌ½¶ą£¬Ōņ“ÅŠŌŌ½“󣬓żĒĀ¼ŠŌÄÜŌ½ŗĆ”£Ąė×ÓŠĶŃõ»ÆĪļV2O5ŗĶCrO2£¬ĘäÖŠŹŹŗĻ×÷Ā¼Ņō“ų“Å·ŪŌĮĻµÄŹĒ_____”£

£Ø4£©ĆĢµÄŅ»ÖÖÅäŗĻĪļµÄ»ÆѧŹ½ĪŖMn(BH4)2(THF)3£¬Š“³öĮ½ÖÖÓėBH4-»„ĪŖµČµē×ÓĢåµÄĪ¢Į£_____£ØĒėŠ“Ņ»øö·Ö×ÓŗĶŅ»øöĄė×Ó£©”£
£Ø5£©ZnSŌŚÓ«¹āĢ唢¹āµ¼Ģå²ÄĮĻ”¢ĶæĮĻ”¢ŃÕĮĻµČŠŠŅµÖŠÓ¦ÓĆ¹ć·ŗ£¬Į¢·½ZnS¾§ĢåµÄ½į¹¹ČēĶ¼ĖłŹ¾£¬aµÄÅäĪ»ŹżĪŖ_____£¬ŅŃÖŖ¾§°ūĆܶČĪŖ¦Ń g/cm3£¬ŌņĻąĮŚ2øöbĪ¢Į£Ö®¼äµÄ¾ąĄėĪŖ_____nm£ØĮŠ¼ĘĖćŹ½£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀ£¬Ä³ČŻĘ÷ÖŠø÷Ī¢Į£ŌŚ·“Ó¦Ē°ŗó±ä»ÆµÄŹ¾ŅāĶ¼ČēĻĀ£¬ĘäÖŠ”ńŗĶ”š“ś±ķ²»Ķ¬ŌŖĖŲµÄŌ×Ó”£

¹ŲÓŚ“Ė·“Ó¦µÄĖµ·Ø²»ÕżČ·µÄŹĒ
A. ·“Ó¦Īļ×ÜÄÜĮæŅ»¶ØµĶÓŚÉś³ÉĪļ×ÜÄÜĮæ B. Ņ»¶ØŹōÓŚæÉÄę·“Ó¦
C. Ņ»¶ØÓŠ·Ē¼«ŠŌ¹²¼Ū¼ü¶ĻĮŃ D. Ņ»¶ØŹōÓŚŃõ»Æ»¹Ō·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼ģŃéijČÜŅŗÖŠŹĒ·ńŗ¬ÓŠNa+”¢K+”¢Fe3+”¢Mg2+”¢Cl-”¢I-”¢CO32-”¢SO42-£¬ĻŽÓĆŹŌ¼ĮÓŠ£ŗŃĪĖį”¢ĮņĖį”¢ĻõĖį±µČÜŅŗ”¢ĻõĖįŅųČÜŅŗ”£Éč¼ĘČēĻĀŹµŃé²½Öč£¬²¢¼ĒĀ¼Ļą¹ŲĻÖĻó£ŗ
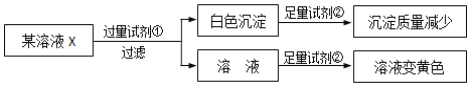
(ŅŃÖŖ£¬NO3-ŌŚĖįŠŌĢõ¼žĻĀ¾ßÓŠĒæŃõ»ÆŠŌ)
ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
A. ŹŌ¼Į¢ŁĪŖĻõĖį±µ
B. ŹŌ¼Į¢ŚŅ»¶ØĪŖŃĪĖį
C. øĆČܱ»ÖŠŅ»¶ØÓŠI-”¢CO32-”¢SO42-£»Na+”¢K+ÖĮÉŁŗ¬ÓŠŅ»ÖÖ
D. ĶعżŌŚ»ĘÉ«ČÜŅŗÖŠ¼ÓČėĻõĖįŅųæÉŅŌ¼ģŃéŌČÜŅŗÖŠŹĒ·ń“ęŌŚC1-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚKIČÜŅŗÖŠ“ęŌŚĻĀĮŠĘ½ŗā£ŗI2(aq)+I-(aq)![]() I3- (aq)”£Ä³I2”¢KI»ģŗĻČÜŅŗÖŠI3-µÄĪļÖŹµÄĮæÅضČc(I3-)ÓėĪĀ¶ČTµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ØĒśĻßÉĻČĪŗĪŅ»µć¶¼±ķŹ¾Ę½ŗāדĢ¬£©”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
I3- (aq)”£Ä³I2”¢KI»ģŗĻČÜŅŗÖŠI3-µÄĪļÖŹµÄĮæÅضČc(I3-)ÓėĪĀ¶ČTµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ØĒśĻßÉĻČĪŗĪŅ»µć¶¼±ķŹ¾Ę½ŗāדĢ¬£©”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. ·“Ó¦I2£Øaq£©+I-(aq) ![]() I3- (aq)µÄ¦¤H>0
I3- (aq)µÄ¦¤H>0
B. ČōĪĀ¶ČĪŖT1”¢T2Ź±£¬·“Ó¦µÄĘ½ŗā³£Źż·Ö±šĪŖK1”¢K2£¬ŌņK1£¼K2
C. Čō·“Ó¦½ųŠŠµ½×“Ģ¬DŹ±£¬Ņ»¶ØÓŠv(Õż) > v(Äę)
D. דĢ¬AÓėדĢ¬BĻą±Č£¬×“Ģ¬AµÄc(I2)“ó
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com