
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O |
分析 A.氢离子来自水的电离,水应该保留分子式;
B.硫氢根离子部分水解生成硫化氢和氢氧根离子,溶液显示碱性;
C.二氧化碳过量,反应生成碳酸氢钙和次氯酸;
D.醋酸为弱酸,离子方程式中醋酸不能拆开.
解答 解:A.惰性电极电解饱和氯化钠溶液,生成NaOH、氢气、氯气,正确的离子反应为:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,故A错误;
B.NaHS溶液呈碱性的原因是硫氢根离子部分水解所致,正确的离子方程式为:HS-+H2O?H2S+OH-,故B错误;
C.过量CO2通入Ca(ClO)2溶液中,反应生成碳酸氢钙和次氯酸,反应的离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,故C正确;
D.醋酸为弱酸,离子方程式中应该保留分子式,正确的离子方程式为:CO32-+2CH3COOH=H2O+CO2↑+2CH3COO-,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,题目难度中等,明确发生的化学反应的实质为解答本题的关键,注意掌握水解原理与弱电解质的电离的区别,试题培养了学生灵活应用基础知识的能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
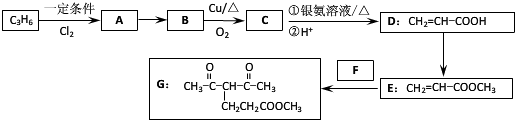
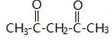 .
.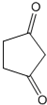 +CH2=CH-NO2$\stackrel{一定条件}{→}$
+CH2=CH-NO2$\stackrel{一定条件}{→}$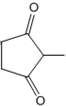 CH2CH2NO2
CH2CH2NO2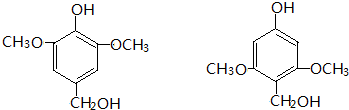 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
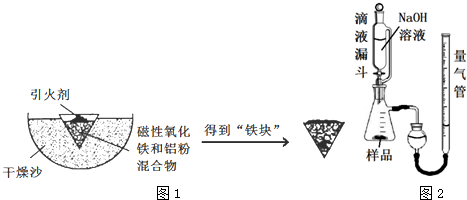
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知白磷(P4)为正四面体形,12.4 g白磷中则含有共价键数为0.4 NA | |
| B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移 | |
| C. | 在0.1 mol/L碳酸钠溶液中Na+总数等于0.2 NA | |
| D. | 电解精炼铜时,当电路中转移NA个电子时,阴极增重32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
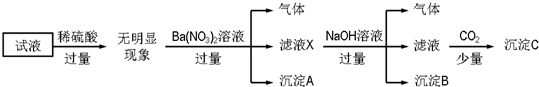
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
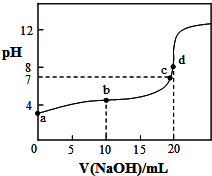 室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点:由水电离出的c(H+)=1.0×10-3mol/L | |
| B. | b点:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) | |
| C. | c点:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | d点:c(OH-)-c(H+)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2 | B. | CuCO3 | C. | CuCO3•CuO | D. | Cu2(OH)2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com