
某温度下,将等物质的量的P与Q投入体积固定2L密闭容器中,发生反应2P(g)+Qg)⇌xW(g)+U(g),经5min后到达平衡,这5min内W的平均反应速率是0.2mol/(L•min),平衡时U的浓度为0.5mol/L,[P]:[Q]=1:2,下列说法中不正确的是( )
|
| A. | x值是2 |
|
| B. | P平衡转化率为66.7% |
|
| C. | 平衡常数为1 |
|
| D. | 反应前,Q的物质的量为3 mol |
考点:
化学平衡的计算.
专题:
化学平衡专题.
分析:
依据经5min后到达平衡,这5min内W的平均反应速率是0.2mol/(L•min),W的平衡浓度为1mol/L,平衡时U的浓度为0.5mol/L,x:1=1:0.5,计算得到x=2;依据化学平衡三段式列式计算,经5min后到达平衡,这5min内W的平均反应速率是0.2mol/(L•min),生成W物质的量=0.2mol/(L•min)×5min×2L=2mol,平衡时U的浓度为0.5mol/L,U物质的量=0.5mol/L×2L=1mol,设P与Q起始物质的量为m;
2P(g)+Q(g)⇌2W(g)+U(g)
起始量(mol) m m 0 0
变化量(mol) 2 1 2 1
平衡量(mol) m﹣2 m﹣1 2 1
[P]:[Q]=1:2,(m﹣2):(m﹣1)=1:2
m=3
据此计算选项分析判断.
解答:
解:依据经5min后到达平衡,这5min内W的平均反应速率是0.2mol/(L•min),W的平衡浓度为1mol/L,平衡时U的浓度为0.5mol/L,x:1=1:0.5,计算得到x=2;依据化学平衡三段式列式计算,经5min后到达平衡,这5min内W的平均反应速率是0.2mol/(L•min),生成W物质的量=0.2mol/(L•min)×5min×2L=2mol,平衡时U的浓度为0.5mol/L,U物质的量=0.5mol/L×2L=1mol,设P与Q起始物质的量为m;
2P(g)+Q(g)⇌2W(g)+U(g)
起始量(mol) m m 0 0
变化量(mol) 2 1 2 1
平衡量(mol) m﹣2 m﹣1 2 1
[P]:[Q]=1:2,(m﹣2):(m﹣1)=1:2
解得m=3,
A、经5min后到达平衡,这5min内W的平均反应速率是0.2mol/(L•min),W的平衡浓度为1mol/L,平衡时U的浓度为0.5mol/L,x:1=1:0.5,则x=2,故A正确;
B、P平衡转化率=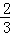 ×100%=66.7%,故B正确;
×100%=66.7%,故B正确;
C、依据上述计算利用平衡浓度计算平衡常数,平衡常数为=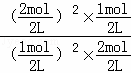 =2,故C错误;
=2,故C错误;
D、上述计算可知反应前,Q的物质的量为3 mol,故D正确;
故选C.
点评:
本题考查了化学平衡计算的分析应用,主要是三段式计算转化率、平衡常数的方法,掌握基础是关键,题目难度中等.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
下列物质的熔点或液化温度由高到低顺序的是( )
|
| A. | 金刚石>晶体硅>碳化硅 | B. | CF4>CCl4>CBr4 |
|
| C. | NH3>N2>H2 | D. | 纯镁>镁铝合金>纯铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据:
| A | B | C | D | E | F | |
| 主要化合价 | ﹣1 | ﹣3+5 | ﹣2+6 | ﹣1+7 | +2 | +1+2 |
| 原子半径 | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)B的氢化物中心原子采取 杂化,空间构型是 形,是 分子(填“极性”或“非极性”);
(3)F2+与NH3形成配离子的结构式为 + ;往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物.写出沉淀溶解的离子方程式 .
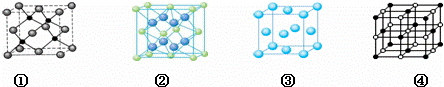
(4)A、E两种元素形成晶体晶胞是图中的 (填①、②、③或④);
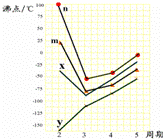
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线 (填n、m、x或y).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实与平衡移动无关的是( )
|
| A. | 氯气难溶于饱和食盐水 |
|
| B. | 用加压的方法促进CO2在水中的溶解 |
|
| C. | FeCl3+3KSCN⇌Fe(SCN)3+KCl,向体系中加入KCl固体 |
|
| D. | 合成氨工业中,及时将氨气液化移出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,现有三种酸,a盐酸、b乙酸、c硫酸的稀溶液,下列说法正确的是( )
|
| A. | 同浓度,pH由大到小:c>a>b |
|
| B. | 同浓度同体积,分别与氢氧化钠中和,所需的氢氧化钠的物质的量由大到小:c>a>b |
|
| C. | 同pH,物质的量浓度由大到小:b>a>c |
|
| D. | 同pH同体积,分别于少量且质量相同的Zn片反应,反应所需时间由长到短:b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )
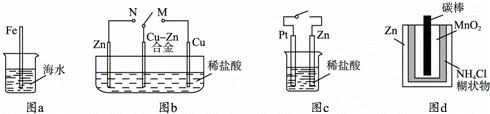
|
| A. | 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
|
| B. | 图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小 |
|
| C. | 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
|
| D. | 图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com